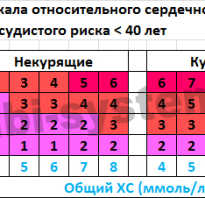
Особенности жизни с постинфарктным кардиосклерозом


- Главная
- О нас
- Вход
- Регистрация
- Поиск
- Текущий выпуск
- Архивы
ОСОБЕННОСТИ ВАРИАБЕЛЬНОСТИ СЕРДЕЧНОГО РИТМА У ПАЦИЕНТОВ С ПОСТИНФАРКТНЫМ КАРДИОСКЛЕРОЗОМ И У ПАЦИЕНТОВ С ФАКТОРАМИ РИСКА РАЗВИТИЯ СЕРДЕЧНО-СОСУДИСТЫХ ЗАБОЛЕВАНИЙ
Аннотация
Введение. Изучение измерений на электрокардиограмме (ЭКГ) тесно связано с желудочковой эктопией, анализ их взаимосвязи с вегетативной регуляцией дает основания для новых способов диагностики и лечения риск-стратифицированных маркеров внезапной сердечной смерти.
Целью исследования была разработка новых подходов к прогнозированию и профилактике появления опасных для жизни аритмий у пациентов с высоким и очень высоким суммарным сердечно-сосудистым риском на основании оценки состояния и влияния на вариабельность сердечного ритма.
Материал и методы. Проанализированы протоколы холтеровского мониторирования сердечного ритма пациентов с ишемической болезнью сердца и факторами риска сердечно-сосудистых заболеваний по шкале SCORE.
Результаты и выводы. У лиц с высоким кардиоваскулярным риском по шкале SCORE установлен повышенный уровень стрессогенности, у лиц с очень высоким кардиоваскулярным риском показатели вариабельности сердечного ритма идентичны, как и у лиц с уже имеющимся сердечно-сосудистым заболеванием.
Ключевые слова
Полный текст:

Литература
Витриховський, А. І. Поширеність шлуночкової екстрасистолії та явища турбулентності серцевого ритму серед осіб з серцево-судинними захворюваннями та факторами ризику виникнення серцево-судинних події за шкалою SCORE / А. І. Витриховський // Український терапевтичний журнал. – 2017. – № 1. – С. 57-65.
Vytryhovskiy AІ Poshirenіst shlunochkovoї ekstrasistolії ta yavishcha turbulentnostі sertsevogo ritmu sered osіb z sertsevo-sudinnimi zakhvoryuvannyami ta faktorami riziku viniknennya sertsevo-sudinnikh podії za shkaloyu SCORE. Ukraїnskiy terapevtichniy zhurnal. 2017;1:57-65. (Ukrainian).
Meta-analysis: secondary prevention programs for patients with coronary heart diseases / A. M. Сlark [et al.] // Ann. Intern. Med. – 2005. – Vol. 143, iss. 9. – P. 659-672.
Сlark AM, Hartling L, Vandermeer B, McAlister FA. Meta-analysis: secondary prevention programs for patients with coronary heart diseases. Ann. Intern. Med. 2005;143(9):659-672.
European guidelines on cardiovascular disease prevention in clinical practice: executive summary: Fourth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (Constituted by representatives of nine societies and by invited experts) [Electronic resource] / I. Graham [et al.] // Eur. Heart J. – 2007. – Vol. 28, iss. 19. – P. 2375-2414. – Mode of access: https://doi.org/10.1093/ eurheartj/ehm316. – Date of access: 10.01.2018.
Graham I, Atar D, Borch-Johnsen K, Boysen G, Burell G., Cifkova R, Dallongeville J, Backe G, Ebrahim S, Gjelsvik B, Herrmann-Lingen C, Hoes A, Humphries S, Knapton M, Perk J, Priori SG, Pyorala K, Reiner Z, Ruilope L, Sans-Menendez S, Reime WS, Weissberg P, Wood D, Yarnell J, Zamorano JL. European guidelines on cardiovascular disease prevention in clinical practice: executive summary: Fourth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (Constituted by representatives of nine societies and by invited experts). Eur. Heart J. 2007;28(19):2375-2414. Available from: https://doi. org/10.1093/eurheartj/ehm316. (accessed 10.01.2018).
Heart rate variability: standards of Measurement, Physiological interpretation and clinical use / Task Force of the European Society of Cardiology, North American Society of Pacing and Electrophysiology // Circulation. – 1996. – Vol. 93, iss. 5. – P. 1043-1065.
Task Force of the European Society of Cardiology, North American Society of Pacing and Electrophysiology. Heart rate variability: standards of Measurement, Physiological interpretation and clinical use. Circulation;1996;93(5):1043-1065.
European Guidelines on cardiovascular diseases prevention in clinical practice (version 2012): The Fifth Join Task Force of the European Society of cardiovascular other Societies on Cardiovascular Diseases Prevention in Clinical Practice (constituted by representatives of nine societies and by invited experts / J. Perk [et al.] ; European Association for Cardiovascular Prevention & Rehabilitation (EACPR), ESC Committee for Practice Guidelines (CPG) // Eur. Heart J. – 2012. – Vol. 33, iss. 13. – P. 1635-1701. – doi: 10.1093/eurheartj/ths092.
Perk J, De Backer G, Gohlke H, Graham I, Reiner Z, Verschuren M, Albus C, Benlian P, Boysen G, Cifkova R, Deaton C, Ebrahim S, Fisher M, Germano G, Hobbs R, Hoes A, Karadeniz S, Mezzani A, Prescott E, Ryden L, Scherer M, Syvänne M, Scholte op Reimer WJ, Vrints C, Wood D, Zamorano JL, Zannad F; European Association for Cardiovascular Prevention & Rehabilitation (EACPR), ESC Committee for Practice Guidelines (CPG). European Guidelines on cardiovascular diseases prevention in clinical practice (version 2012). The Fifth Join Task Force of the European Society of cardiovascular other Societies on Cardiovascular Diseases Prevention. Eur. Heart J. 2012;33(13):1635-1701. doi: 10.1093/eurheartj/ehs092.
Risk stratification for sudden cardiac death / I. N. Sabir [et al.] // Prog. Biophys. Mol. Biol. – 2008. – Vol. 98, iss. (2-3). – P. 340-346. – doi: 10.1016/j. pbiomolbio.2009.01.013.
Sabir IN, Usher-Smith JA, Huang CL, Grace AA. Risk stratification for sudden cardiac death. Prog. Biophys. Mol. Biol. 2008;98(2-3):340-346. doi: 10.1016/j.pbiomolbio. 2009.01.013.
Ссылки
- На текущий момент ссылки отсутствуют.
Креативная кардиология. 2013; 2: 5-14
Элемент не найден
Электронная подписка
Для получения доступа к тексту статей журнала воспользуйтесь услугой «Электронная подписка»:
Главный редактор
Лео Антонович Бокерия, доктор медицинских наук, профессор, академик РАН и РАМН, директор
Академик РАН и РАМН Лео Антонович БОКЕРИЯ,
директор им. А.Н. Бакулева,
главный редактор издательства Центра
Кардиохирург, ученый, педагог и организатор науки, доктор медицинских наук (1973 г.), профессор (1982 г.), академик РАМН (1994 г.), академик РАН (2011 г.), заслуженный деятель науки РФ (1994 г.), лауреат Ленинской премии (1976 г.), Государственной премии СССР (1986 г.), Государственной премии РФ (2002 г.), Премии Правительства РФ (2003 г.).
В 1994 г. Л.А. Бокерия избран по конкурсу на должность директора им. А.Н. Бакулева. В 1998 г. одновременно становится директором Центра хирургической и интервенционной аритмологии МЗ РФ.
С 1994 г. является заведующим кафедрой сердечно-сосудистой хирургии Российской медицинской академии последипломного образования (РМАПО) МЗ РФ. С 1995 г. заведует созданной им кафедрой сердечно-сосудистой хирургии № 2 Московской медицинской академии (ныне Первого МГМУ) им. И.М. Сеченова МЗ РФ.
С 2003 г. возглавляет кафедру сердечно-сосудистой хирургии и интервенционной кардиологии Московского государственного медико-стоматологического университета им. А.И. Евдокимова МЗ РФ.
По инициативе Л.А. Бокерия в успешно функционирует учебно-исследовательский центр «Современные медицинские технологии», который ежегодно проводит 4–6 курсов последипломного повышения квалификации специалистов высшего звена.
Л.А. Бокерия выполняет весь известный арсенал операций на сердце при самой разнообразной патологии: от 3 до 6 операций в день, то есть от 700 до 900 операций с использованием искусственного кровообращения в год.
С 1996 г. он является главным кардиохирургом МЗ РФ.
Л.А. Бокерия – автор и соавтор свыше 3700 научных публикаций, в том числе более 250 книг, более 100 изобретений и полезных моделей, более 300 программ и баз данных для ЭВМ, ряд которых зарегистрированы за рубежом, по различным проблемам сердечно-сосудистой хирургии, кардиологии, медицинского образования и организации медицинской науки.
Л.А. Бокерия принадлежат уникальные работы по теоретическому обоснованию и клиническому использованию метода гипербарической оксигенации в хирургии сердца и сосудов. Он крупнейший специалист в области диагностики и хирургического лечения нарушений ритма и проводимости сердца (особенно тахиаритмий), включая различные сочетания сердечных аритмий с врожденными и приобретенными пороками и аномалиями развития сердца, коронарной болезнью.
Л.А. Бокерия является инициатором развития и другого нового раздела кардиохирургии в нашей стране – минимально инвазивной хирургии сердца. Большой вклад внес Л.А. Бокерия в решение проблемы хирургического лечения ИБС.
Велика роль Л.А. Бокерия в разработке новых подходов к хирургическому лечению терминальной сердечной недостаточности. Его заслугой является разработка новых операций у тяжелой категории кардиохирургических больных с различными формами кардиомиопатий. Он первым развил концепцию динамической кардиомиопластики, в том числе и у детей. Л.А. Бокерия выполнил первую в нашей стране имплантацию искусственного желудочка сердца и после большого перерыва инициировал возобновление в Центре выполнения операций по трансплантации сердца.
По инициативе Л.А. Бокерия в клиническую практику внедрены передовые технологии диагностики и реконструктивной хирургии заболеваний восходящего отдела и дуги аорты.
Он генерировал развитие и другого направления современной медицинской науки – креативной кардиологии, которая определяет необходимость созидательного сотрудничества врачей разных специальностей: кардиологов, кардиохирургов, специалистов по функциональной диагностике, фундаментальным и прикладным дисциплинам.
Под руководством Л.А. Бокерия в Центре разрабатываются и внедряются в клиническую практику новые высокотехнологичные принципы профилактики и лечения больных с сердечно-сосудистой патологией – использование методов генной и клеточной терапии.
Академик Л.А. Бокерия проводит приоритетные исследования по созданию биопротезов клапанов сердца для коррекции клапанных пороков – низкопрофильного, изогнутого по плоскости биопротеза митрального и трикуспидального клапанов, воспроизводящего естественную форму фиброзного кольца, на упругоподатливом каркасе. Продолжено изучение эффективности защиты миокарда у детей первого года жизни при применении нового внутриклеточного кардиоплегического раствора «Бокерия – Болдырева», созданного в под руководством Л.А. Бокерия.
Л.А. Бокерия активно занимается методологией медицинской науки и педагогической деятельностью. Он является создателем крупнейшей в стране кардиохирургической школы, воспитавшим не одно поколение врачей – кардиохирургов, кардиологов, реаниматологов и специалистов других смежных специальностей.
Л.А. Бокерия – научный руководитель 350 кандидатских и консультант более 100 докторских диссертаций. Он создатель издательства им. А.Н. Бакулева с типографией, основатель и главный редактор журналов «Анналы хирургии», «Бюллетень им. А.Н. Бакулева «Сердечно-сосудистые заболевания», «Детские болезни сердца и сосудов», «Клиническая физиология кровообращения», «Анналы аритмологии», «Креативная кардиология», информационного сборника «Сердечно-сосудистая хирургия»; главный редактор журнала «Грудная и сердечно-сосудистая хирургия».
Активная деятельность Л.А. Бокерия и его вклад в отечественное здравоохранение отмечены званиями и премиями самого высокого достоинства. Он лауреат Ленинской премии (1976 г.), двух Государственных премий (1986 г. – СССР, 2002 г. – РФ), Премии Правительства Российской Федерации (2003 г.). За выдающиеся достижения Л.А. Бокерия награжден орденом «За заслуги перед Отечеством» III (1999 г.), II (2004 г.) и IV (2010 г.) степени, орденом Достоинства и Чести (Республика Грузия, 1999 г.), орденом Преподобного Сергия Радонежского II степени (2001 г.). Русский биографический институт неоднократно признавал Л.А. Бокерия «Человеком года», а в 2000 г. – «Человеком десятилетия» в номинации «Медицина». В 2002 г. он удостоен титула «Человек-легенда», общероссийской премии «Русский национальный Олимп», учрежденной Правительством, Союзом промышленников и фондом «Третье тысячелетие». Как одному из ведущих кардиохирургов мира в 2003 г. Л.А. Бокерия вручена международная премия «Золотой Гиппократ». В 2004 г. он удостоен премии РАН «Триумф» в номинации «Наука о жизни – медицина». В 2004 г. он отмечен наградным знаком – орденом «Меценат», который присуждается Благотворительным фондом «Меценаты столетия» за выдающийся вклад в дело возрождения и процветания мира, за величие души, за бескорыстную щедрость; в 2004 и 2005 г. – Золотым почетным знаком «Общественное признание», который присуждается Национальным фондом «Общественное признание», Национальным гражданским комитетом по взаимодействию с правоохранительными, законодательными и судебными органами и независимой организацией «Гражданское общество» за большой личный вклад в развитие отечественной медицины, проведение уникальных кардиохирургических операций с применением новейших медицинских технологий, спасших жизни сотен детей и новорожденных, многолетнюю и плодотворную научно-практическую, педагогическую и просветительскую деятельность, активную гражданскую позицию.
В 2006 г. Л.А. Бокерия награжден Почетным алмазным орденом «Общественное признание», удостоен диплома Президиума Парламента народов России «за спасение многочисленных жизней, выдающиеся знания, умение руководить, за уникальные личные качества – благородство, мужество, чувство долга, умение беречь честь и достоинство, держать слово и делать дело, в также за веру в великое будущее Отечества», Золотой медали – за выдающийся вклад в образование России и Золотой звезды «Честь, гордость и слава России».
В 2008 г. Л.А. Бокерия награжден медалью «За практический вклад в укрепление здоровья нации», Орденом Чести с присуждением звания «Опора честного бизнеса» и почетного титула «Выдающийся кардиохирург современности». В 2009 г. огромный вклад Л.А. Бокерия в науку и отечественное здравоохранение отмечен присуждением ему Премии имени А.Н. Косыгина «За большие достижения в решении проблем развития экономики России» и премии города Москвы в области медицины «за разработку и внедрение в клиническую практику нового биологического клапана «Биоглис».
Л.А. Бокерия – действительный член Американской ассоциации торакальных хирургов (1991 г.), член правления (1992 г.) и член Президиума (с 2003 г., консул) Европейского общества грудных и сердечно-сосудистых хирургов, член правления Европейского общества сердечно-сосудистых хирургов, член научного правления Международного кардиоторакального центра Монако (1992 г.), член Сербской академии наук (1997 г.), почетный член Американского колледжа хирургов (1998 г.), академик АМН Украины, почетный профессор МГУ им. М.В. Ломоносова (2011 г.), иностранный член Национальной Академии наук Грузии (2012 г.).
Он президент Ассоциации сердечно-сосудистых хирургов России (1995 г.), президент Общероссийской общественной организации «Лига здоровья нации» (2003 г.), член Общественной палаты РФ всех созывов.
Особенности жизни с постинфарктным кардиосклерозом
УДК: 616.12-008.46-036.12:616-61-07]:616.127-005.8-06
Год издания: 2016
Тревожно-депрессивные расстройства у пациентов с хронической сердечной недостаточностью ишемического генеза
Мацкевич С.А., Барбук О.А., Бельская М.И., Карпова И.С., Соловей С.П.
Рубрики: 76.29.30, 76.29.36
Республиканский научно-практический центр Кардиология
Тема НИР: «Разработать и внедрить метод диагностики дисфункции почек при хронической сердечной недостаточности у пациентов с постинфарктным кардиосклерозом».
Сроки выполнения НИР: январь 2013 г. — декабрь 2015 г.
Научный руководитель: канд. мед. наук С.А. Мацкевич.
Источник финансирования: госбюджет.
В общемедицинской практике сочетание тревожной и депрессивной симптоматики встречается, по некоторым данным, в 60-70% случаев. Важно отметить тесную коморбидность депрессивных и тревожных расстройств. Часто депрессия сопровождается более или менее выраженной тревожной симптоматикой, у части пациентов тревога выступает в качестве продромального признака депрессии. Тревожные и депрессивные расстройства служат независимым фактором риска развития ишемической болезни сердца (ИБС), способствуют повышению частоты сердечно-сосудистых осложнений и смертности среди пациентов кардиологического профиля. Коморбидные соматическим заболеваниям депрессии значительно отягощают клиническое течение соматических заболеваний, затрудняют проведение реабилитации и вторичной профилактики, ухудшают качество жизни (КЖ) пациентов и отрицательно влияют на прогноз. Результаты семилетнего проспективного исследования (Pfiffner D. et al., 2000) показали, что независимыми предикторами смертности пациентов, перенесших острый инфаркт миокарда, помимо тяжести ИБС были депрессия, тревога и недостаток социальной поддержки.
Цель — определить наличие и выраженность тревожно-депрессивных переживаний и оценить их влияние на качество жизни у пациентов с хронической сердечной недостаточностью (ХСН) ишемического генеза.
Согласно результатам психологического тестирования по шкале HADS (Hospital Anxiety and Depression Scale) тревожные и депрессивные переживания выявлены у 45,5% пациентов с ХСН (всего обследовано 132 человека). Признаки изолированной депрессии определялись в 22,7% случаев, тревоги — в 24,2%. Причем признаки клинически выраженной тревоги и депрессии выявлены у 6,8 и 4,5% пациентов соответственно, признаки субклинически выраженной тревоги и депрессии — у 17,4 и 18,2%. Все эти особенности накладывают отпечаток на качество жизни, которое у пациентов с сопутствующими тревожно-депрессивными переживаниями в 1,5 раза хуже, чем у лиц с нормальным психоэмоциональным статусом. Депрессией и тревогой одновременно страдают 10,6% пациентов; качество жизни в этой группе в 1,6 раза хуже, чем у пациентов без данных расстройств. В результате корреляционного анализа выявлены положительные взаимосвязи между КЖ и уровнем депрессии (r=0,45, р<0,001), КЖ и уровнем тревоги (r=0,59, р<0,001), между уровнями депрессии и тревоги (r=0,46, р<0,001).
При ХСН ФК III тревожно-депрессивные переживания (по данным шкалы HADS) выявлены у 70,2% пациентов. Признаки изолированной депрессии и тревоги определялись в 47,4 и 22,8% случаев соответственно. Качество жизни у лиц с сопутствующими тревожно-депрессивными состояниями в 1,6 раза хуже, чем у пациентов с нормальным психоэмоциональным статусом. Выраженность тревоги и депрессии у пациентов с ХСН ФК III превышает нормальные значения по шкале HADS в 1,4 и 1,7 раза соответственно. В этой группе выявлена корреляционная зависимость между качеством жизни и уровнем депрессии (r=0,49, р<0,001), качеством жизни и уровнем тревоги (r=0,57, р<0,001). У 12,2% обследованных отмечены признаки и тревоги и депрессии, КЖ в этой группе хуже, чем при изолированном состоянии (р<0,01).
Таким образом, тревожно-депрессивные переживания у пациентов с ХСН ишемического генеза выявляются в 45,5% случаев. Качество жизни этих лиц значительно ухудшается при наличии тревоги и/или депрессии, причем при их сочетании это носит наиболее выраженный характер. Утяжеление сердечной недостаточности коррелирует с увеличением числа пациентов с тревожно-депрессивными переживаниями; отмечено, что при ХСН ФК II превалируют тревожные переживания, при ХСН ФК III — депрессивные. Выявленные изменения свидетельствуют о необходимости коррекции тревожно-депрессивных расстройств в комплексном лечении пациентов с сердечной недостаточностью с целью улучшения клинического состояния и повышения качества их жизни.
Область применения: кардиология, терапия.
Рекомендации по использованию: для внедрения в работу ЛПУ Республики Беларусь (в настоящее время ведется работа по внедрению результатов исследования).
Предложения по сотрудничеству: клинико-консультативная помощь.
- Домашняя страница
- О нас
- Войти
- Зарегистрироваться
- Поиск
- Текущий выпуск
- Архивы
Структурно-функциональные изменения сердца и клинические особенности сердечной недостаточности с сохраненной фракцией выброса левого желудочка у больных, перенесших инфаркт миокарда, коморбидный с артериальной гипертензией
Аннотация
У 91 больного с постинфарктным кардиосклерозом и сохраненной фракцией выброса левого желудочка (ФВ>45%) с артериальной гипертензией с помощью оценки клинического состояния и эходопплеркардиографии исследовали структурно-функциональные изменения сердца и клинические особенности течения сердечной недостаточности. Обнаружили, что у больных с постинфарктным кардиосклерозом и диастолической сердечной недостаточностью с коморбидной артериальной гипертензией тяжесть клинических проявлений сердечной недостаточности коррелирует с индексом объема левого предсердия и маркерами диастолической дисфункции
E’ и E/E’. У пациентов с постинфарктным кардиосклерозом и артериальной гипертензией с диастолической сердечной недостаточностью определяют преимущественно концентрическую гипертрофию с увеличением индекса объема левого предсердия и умеренной дилатацией левого желудочка и диастолическую дисфункцию по типу нарушения релаксации.
Ключевые слова
Полный текст:
Литература
Бунова С.С. Клиническая характеристика дисфункции миокарда левого желудочка у пациентов, перенесших круп
ноочаговый инфаркт миокарда / С.С. Бунова, Е.В. Усачева,
А.В. Нелидова // Сердечная недостаточность. – 2012. – Т.
Викентьев В.В. Ишемия миокарда и нарушение диастолической функции левого желудочка / В.В. Викентьев // Русский медицинский журнал. – 2000. – №5. – С. 56–57.
Козина А.А. Ремоделирование и диастолическая функция левого желудочка в зависимости от вариабельности артериального давления у больных артериальной гипертензией и ишемической болезнью сердца / А.А. Козина, Ю.А. Васюк, Е.Н. Ющук // Артериальная гипертензия. – 2003. – Т. 9(4). – С. 124–127.
Национальные рекомендации ВНОК И ОССН по диагностике и лечению ХСН (третий пересмотр) // Сердечная недостаточность. – 2010. – Т. 11. – № 1. – С. 2–62.
Носенко Н.Н. Тканевая миокардиальная допплер-эхокардиография: возможности и ограничения метода / Н.Н. Носенко, С.В. Поташев, Т.В. Симагина, Н.А. Перепельченко, М.Н. Долженко // Внутренняя медицина. – 2007. – № 6. – С. 68–74.
Свищенко Е.П. Диастолическая сердечная недостаточность / Е.П. Свищенко, Е.А. Матова // Сердечная недостаточность.– 2009. – № 1. – С. 47–54.
Терещенко С.Н. Диастолическая дисфункция левого желудочка и ее роль в развитии хронической сердечной недостаточности / С.Н. Терещенко, И.В. Демидова, Л.Г. Александрия, Ф.Т. Агеев // Сердечная недостаточность. – 2000. – Т. 1. – № 2. – С. 61–65.
Щукин Ю.В. Диастоло-систолическая дисфункция сердца при сердечной недостаточности у больных с постинфарктным кардиосклерозом / Ю.В. Щукин, О.В. Фатенков. // Нижегородский медицинский журнал. – 2002. – № 2. – С. 19–23.
Arques S. Current clinical applications of spectral tissue Doppler echocardiography (E/E’ ratio) as a noninvasive surrogate for left ventricular diastolic pressures in the diagnosis of heart failure with preserved left ventricular systolic function. / S. Arques, Е. Roux, R. Luccioni // Cardiovascular Ultrasound. – 2007. – Vol. 26. – Р. 5–16.
Panupong Jiamsripong Three methods for evaluation of left
atrial volume / Panupong Jiamsripong, Tadaaki Honda // Eur. J. of Echocardiography. – 2008. – Vol. 9. – P. 351–355.
Gerdts E. Impact of left ventricular geometry on prognosis in hypertensive patients with left ventricular hypertrophy (the LIFE study) / E. Gerdts, D. Cramariuc, G. de Simone, K. Wachtell, B. Dahlöf, R.B. Devereux // Eur. J. of Echocardiography. – 2008. – Vol. 9. – P. 809–815.
Hogg К. Heart Failure with preserved left ventricular systolic function. Epidemiology, Clinical Characteristics, and Prognosis / К. Hogg, К. Swedberg, J. McMurray // J Am Coll Cardiol. – 2004. – № 43(3). – Р. 317–327.
Jorge A.J.L. Left Atrium Measurement in Patients Suspected of Having Heart Failure With Preserved Ejection Fraction / A.J.L. Jorge, M.L. Ribeiro et al. // Arq. Bras. Cardiol. – 2012. – Vol. 98(2). – P. 175–181.
Nagueh S.F. Recommendations for the Evaluation of Left Ventricular Diastolic Function by Echocardiography / S.F. Nagueh, C.P. Appleton, T.C. Gillebert et al. // Journal of the American Society of Echocardiography. – 2009. – Vol. 22. – P. 107–133.
Walter J. Paulus How to diagnose diastolic heart failure: a consensus statement on the diagnosis of heart failure with normal left ventricular ejection fraction by the Heart Failureand Echocardiography Associations of the European Society of Cardiology / Walter J. Paulus , John E. Sanderson // Eur. Heart J. – 2007. – Vol. 28. – Р. 2539–2550.
Ссылки
- На текущий момент ссылки отсутствуют.
Ишемическая болезнь сердца: симптомы и лечение
Ишемическая болезнь сердца — острое или хроническое поражение миокарда, возникающее вследствие уменьшения или прекращения снабжения сердечной мышцы артериальной кровью, в основе которого лежат патологические процессы в системе коронарных артерий.
ИБС широко распространенное заболевание. Одна из основных причин смертности, временной и стойкой утраты трудоспособности во всем мире. В структуре смертности сердечно-сосудистые заболевания стоят на первом месте, из них на долю ИБС приходится около 40%.
Формы ишемической болезни
Классификация ИБС (МКБ-10; 1992г.)
- Стенокардия
- — Стабильная стенокардия напряжения
- — Нестабльная стенокардия
- Первичный инфаркт миокарда
- Повторный инфаркт миокарда
- Старый (перенесенный ранее) инфаркт миокарда (постинфарктный кардиосклероз)
- Внезапная сердечная (аритмическая) смерть
- Сердечная недостаточность (поражение миокарда вследствие ИБС)
Основной причиной нарушения снабжения миокарда кислородом является несоответствие между коронарным кровотоком и метаболическими потребностями сердечной мышцы. Это может быть следствием:
- — Атеросклероза коронарных артерий с сужением их просвета более, чем на 70%.
- — Спазма неизмененных (малоизмененных) коронарных артерий.
- — Нарушения микроциркуляции в миокарде.
- — Повышения активности свертывающей системы крови (или снижение активности противосвертывающей системы).
Главный этиологический фактор развития ишемической болезни сердца — атеросклероз коронарных артерий. Атеросклероз развивается последовательно, волнообразно и неуклонно. В результате накопления холестерина в стенке артерии формируется атеросклеротическая бляшка. Избыток холестерина приводит к увеличению бляшки в размере, возникают препятствия току крови. В дальнейшем, под воздействием системных неблагоприятных факторов, происходит трансформация бляшки от стабильной до нестабильной (возникают трещины и разрывы). Запускается механизм активации тромбоцитов и образования тромбов на поверхности нестабильной бляшки. Симптомы усугубляютя с ростом атеросклеротической бляшки, постепенно суживающей просвет артерии. Уменьшение площади просвета артерии более чем на 90-95% является критическим, вызывает снижение коронарного кровотока и ухудшение самочувствия даже в покое.
Факторы риска ишемической болезни сердца:
- Пол (мужской)
- Возраст >40-50 лет
- Наследственность
- Курение (10 и более сигарет в день в течение последних 5 лет)
- Гиперлипидемия (общий холестерин плазмы > 240 мг/дл; холестерин ЛПНП > 160 мг/дл)
- Артериальная гипертония
- Сахарный диабет
- Ожирение
- Гиподинамия
Симптомы
Клиническая картина ИБС
Первое описание стенокардии предложил английский врач Уильям Геберден в 1772 году: «. боль в грудной клетке, возникающая во время ходьбы и заставляющая больного остановиться, в особенности во время ходьбы вскоре после еды. Кажется, что эта боль в случае ее продолжения или усиления способна лишить человека жизни; в момент остановки все неприятные ощущения исчезают. После того, как боль продолжает возникать в течение нескольких месяцев, она перестает немедленно проходить при остановке; и в дальнейшем она будет продолжать возникать не только когда человек идет, но и когда лежит…» Обычно симптомы болезни впервые появляются после 50 лет. В начале возникают только при физической нагрузке.
Классическими проявлениями ишемической болезни сердца являются:
- — Боль за грудиной, часто иррадиирует в нижнюю челюсть, шею, левое плечо, предплечье, кисть, спину.
- — Боль давящая, сжимающая, жгучая, душащая. Интенсивность различная.
- — Провоцируются физическими или эмоциональными факторами. В покое прекращаются самостоятельно.
- — Длится от 30 секунд до 5-15 минут.
- — Быстрый эффект от нитроглицерина.
Лечение ишемической болезни сердца
Лечение направлено на восстановление нормального кровоснабжения миокарда и улучшение качества жизни больных. К сожалению, чисто терапевтические методы лечения не всегда эффективны. Существует множество хирургических методов коррекции, таких как: аорто-коронарное шунтирование, трансмиокардиальная лазерная реваскуляризация миокарда и чрескожные коронарные интервеционные вмешательства (баллонная ангиопластика, стентирование коронарных артерий).
«Золотым стандартом» в диагностике обструктивных поражений коронарных артерий сердца считается селективная коронарография. Применяется для того, чтобы узнать существенное ли сужение сосуда, какие артерии и сколько их поражено, в каком месте и на каком протяжении. В последнее время все большее распространение получила мультиспиральная компьютерная томография (МСКТ) с внутривенным болюсным контрастированием. В отличие, от селективной коронарографии, которая по существу является рентгенохирургическим вмешательством на артериальном русле, и выполняется только в условиях стационара, МСКТ коронарных артерий, как правило, выполняется амбулаторно с помощью внутривенного введения контрастного вещества. Еще одним принципиальным отличием может быть то, что селективная коронарография показывает просвет сосуда, а МСКТ и просвет сосуда, и, собственно, стенку сосуда, в которой локализуется патологический процесс.
В зависимости от изменений в коронарных сосудах, выявленных при коронарографии, могут быть предложены различные методы лечения:
Аортокоронарное шунтирование — отработанная в течение многих лет операция, при которой берут собственный сосуд больного и подшивают к коронарной артерии. Тем самым, создается путь обхода пораженного участка артерии. Кровь в нормальном объеме поступает в миокард, что приводит к ликвидации ишемии и исчезновению приступов стенокардии. АКШ является методом выбора при ряде патологических состояний, таких как сахарный диабет, поражение ствола, многососудистое поражение и т.д. Операция может проводиться с искусственным кровообращением и кардиоплегией, на работающем сердце без искусственного кровообращения, и на работающем сердце с искусственным кровообращением. В качестве шунтов могут использоваться, как вены, так и артерии пациента. Окончательное решение о выборе того или иного вида операции зависит от конкретной ситуации и оснащенности клиники.
Популярная в свое время баллонная ангиопластика потеряла свою актуальность. Основная проблема — краткосрочность эффекта от выполненного рентгенохирургического вмешательства.
Более надёжным и, в то же время, малоинвазивным методом восстановления и удержания нормального просвета сосуда, является стентирование. Метод по сути такой же, как баллонная ангиопластика, но на баллончике смонтирован стент (небольшой трансформируемый металический сетчатый каркас). При введении в место сужения, баллон со стентом раздувают до нормального диаметра сосуда, стент прижимается к стенкам и сохраняет свою форму постоянно, оставляя просвет открытым. После установки стента пациенту назначается длительная антиагрегантная терапия. В течение первых двух лет ежегодно выполняется контрольная коронарография.
В тяжелых случаях облитерирующего атеросклероза коронарных артерий, когда нет условий для АКШ и рентгенохирургических вмешательств, пациенту может быть предложена трансмиокардиальная лазерная реваскуляризация миокарда. В этом случае улучшение кровообращения миокарда происходит за счет потока крови напрямую из полости левого желудочка. На пораженную область миокарда хирург помещает лазер, создавая множество каналов диаметром менее 1 миллиметра. Каналы способствуют росту новых кровеносных сосудов, через которые кровь поступает в ишемизированный миокард, обеспечивая его кислородом. Эта операция может выполняться как самостоятельно, так и в сочетании с аортокоронарным шунтированием.
После устранения аортокоронарного стеноза заметно повышается качество жизни, восстанавливается трудоспособность, значительно снижается риск возникновения инфаркта миокарда и внезапной сердечной смерти, увеличивается продолжительность жизни.
В настоящее время диагноз ИБС это не приговор, а повод для активных действий по выбору оптимальной лечебной тактики, которая позволит сохранить жизнь на многие годы.
Особенности тактики хирургического лечения ишемической болезни сердца у пациентов с выраженной дисфункцией миокарда левого желудочка
Полный текст:
- Статья
- Об авторе
- Cited By
Аннотация
Цель: изучить влияние внутрипросветных коронарных шунтов на непосредственные результаты хирургического лечения ишемической болезни сердца у пациентов высокого хирургического риска со сниженной фракцией выброса левого желудочка.
Материалы и методы: проведён ретроспективный анализ историй болезни 96 пациентов с ишемической болезнью сердца и сниженной фракцией выброса левого желудочка, которым выполнена операция коронарного шунтирования. Пациенты были разделены на 2 группы: исследуемую группу составили 47 больных, оперированных в условиях параллельного искусственного кровообращения, которым при выполнении дистальных анастомозов использовали временные внутрикоронарные шунты; контрольная группа была представлена 49 пациентами, также оперированных в условиях параллельного искусственного кровообращения, но у которых при выполнении дистальных анастомозов не использовали интракоронарные шунты. Наблюдение за пациентами проводили вплоть до 12 месяцев после операции.
Результаты: обе группы пациентов были сопоставимы по клинико-демографическим показателям. При анализе интраоперационного и послеоперационного периода выявлена разница в частоте развития нарушений сердечного ритма, остальные показатели были сопоставимы.
Заключение: таким образом, у пациентов со сниженной фракцией выброса левого желудочка внутрикоронарные шунты целесообразно использовать по показаниям, а не во всех случаях проведения операций реваскуляризации миокарда в условиях параллельного искусственного кровообращения.
Ключевые слова
Для цитирования:
Щетко В.Н. Особенности тактики хирургического лечения ишемической болезни сердца у пациентов с выраженной дисфункцией миокарда левого желудочка. Медицинский вестник Юга России. 2018;9(1):99-104. https://doi.org/10.21886/2219-8075-2018-9-1-99-104
For citation:
Shchetko V.N. Features of surgical treatment of ischemic heart disease in patients with the expressed dysfunction left ventricular. Medical Herald of the South of Russia. 2018;9(1):99-104. (In Russ.) https://doi.org/10.21886/2219-8075-2018-9-1-99-104
Введение
Операция аортокоронарного шунтирования (АКШ) в условиях искусственного кровообращения (ИК) давно доказала свою эффективность в качестве оптимального метода лечения пациентов с ишемической болезнью сердца (ИБС) [1]. Однако проведение АКШ в условиях ИК и кардиоплегии связано с дополнительными рисками повреждения миокарда вследствие реперфузионной нагрузки и развития пост- кардиоплегической депрессии миокарда, особенно выраженной среди пациентов с постинфарктным кардиосклерозом (ПИКС) [2]. Эти обстоятельства привели к тому, что в настоящее время всё чаще для восстановления кровоснабжения миокарда прибегают к технике АКШ без ИК, которая, к сожалению, также не лишена определённых рисков, связанных, прежде всего, с необходимостью ротации и вертикализации сердца, а также временного пережатия коронарной артерии (КА) для формирования дистальных анастомозов [3]. Доказано, что проведение основного этапа операции таким способом приводит к локальной ишемии миокарда, степень выраженности которой находится в зависимости от характера поражения сосуда и состояния коллатерального кровотока [4]. Ряд исследователей считает, что окклюзированные или критически стенозированные КА, имеющие развитые коллатерали, являются обязательным условием для проведения АКШ без ИК [5]. Анализ результатов хирургического лечения ИБС у пациентов низкого риска позволил прийти к мнению о том, что окончательное решение о проведении операции без ИК может быть принято интраоперационно, после ревизии коронарных артерий, однако ему непременно должно предшествовать комплексное обследование. Что же касается пациентов высокого хирургического риска, «золотой серединой» между поскар- диоплегическими рисками и техническими опасностями операции на работающем сердце, позволяющей также снизить пред- и постнагрузку, принято считать операцию АКШ с ИК, но без фармакохолодовой кардиоплегии (ФХК) — так называемое, параллельное искусственное кровообращение (ПИК) [6].
Несмотря на увеличение числа пациентов с высоким риском развития периоперационных осложнений, обусловленное расширением критериев отбора, в последние годы летальность при выполнении АКШ значительно снизилась (1-3 % в течение 30 дней после операции). Этому послужило введение новых методов защиты миокарда, а также тот факт, что явление «оглушенного» миокарда (которое в большинстве случаев требует механичсекой и/или инотропной поддержки и проявляется низким сердечным выбросом) — до сих пор достаточно распространённое явление.
С целью снижения выраженности последствий временной ишемии миокарда, сопровождающей основной этап АКШ у пациентов высокого хирургического риска, обусловленного дисфункцией миокарда, было предложено использование временных интракоронарных шунтов, применение прекондиционирования и аортокоронарную перфузию. Ряд актуальных исследований свидетельствуют о высокой эффективности внутрипросветных коронарных шунтов (ВПКШ), которые служат надежной профилактикой ишемии миокарда в момент формирования дистального анастомоза, за счёт установки непосредственно в просвет коронарной артерии, что в свою очередь приводит к сохранению кровотока в коронарных артериях, однако вопрос безопасности и целесообразности их применения остается дискутабельным [7].
В связи с этим актуальной задачей, решение которой позволит повысить безопасность кардиохирургических операций и послеоперационного периода является проблема разработки способов профилактики и лечения ишемических и реперфузионных повреждений миокарда, а также методов его защиты от этих повреждений.
Цель исследования — изучение влияния использования ВПКШ на непосредственные результаты хирургического лечения пациентов с ИБС высокого хирургического риска, обусловленного наличием сниженной сократительной способности миокарда левого желудочка и хронической сердечной недостаточностью (ХСН), возникших в результате перенесённого ранее инфаркта миокарда.
Материалы и методы
Проведён ретроспективный анализ историй болезни 96 пациентов с ИБС и сниженной фракцией выброса левого желудочка (ФВ ЛЖ) (менее 35 %), которым выполнена операция коронарного шунтирования (КШ) в период с 2010 по 2016 гг. Пациентов условно разделили на 2 группы: исследуемая группа (n=47) — пациенты, оперированные в условиях ПИК, которым при выполнении дистальных анастомозов использовали ВПКШ, и контрольная группа (n=49) — пациенты, также оперированные в условиях ПИК, которым при выполнении дистальных анастомозов не использовали ВПКШ. Формирование исследуемой и контрольной группы осуществлялось методом сплошной выборки на основе базы данных отделения кардиохирургического ФГБОУ ВО «РостГМУ» Минздрава России. Критериями включения стали инфаркт миокарда (ИМ) в анамнезе, II-IV функциональный класс ХСН по NYHA, стенокардия напряжения, ФВЛЖ 1. Сидоров Р.В. Современная стратегия коронарного шунтирования у больных ишемической болезнью сердца: автореф. дис. . д-ра мед. наук: 14.01.26 / Российский научный центр хирургии им. академика Б.В. Петровского Российской академии медицинских наук, Москва, 2014.
2. Быстров Д.О. Непосредственные результаты хирургического лечения больных ибс со сниженной фракцией выброса левого желудочка / Быстров Д.О., Шонбин А.Н., Заволожин А.С. и соавт. // Современные исследования социальных проблем. – 2011. – Т. 8., № 4. – С. 98.
3. Чернявский А.М. Хирургическое лечение ишемической болезни сердца у пациентов с низкой фракцией выброса левого желудочка на работающем сердце в условиях искусственного кровообращения: непосредственные результаты / Чернявский А.М., Несмачный А.С., Бобошко А.В. и соавт. // Патология кровообращения и кардиохирургия. – 2015. – Т. 19., № 1. – С. 51-58.
4. Сидоров Р.В. Профилактика реперфузионных повреждений миокарда после операции прямой реваскуляризации миокарда в условиях искусственного кровообращения / Сидоров Р.В., Мартынов Д.В., Петяев А.М. и соавт. // Кардиология и сердечно-сосудистая хирургия. – 2009. – Т. 2., № 6. – С. 35-37.
5. Мерзляков В.Ю. Острая окклюзия коронарной артерии после использования интракоронарного шунта при операции на работающем сердце / Мерзляков В.Ю., Меликулов А.А., Ключников И.В. и соавт. // Бюллетень НЦССХ им. А. Н. Бакулева РАМН. – 2013. – Т. 14, № 1. – С. 72-75.
6. Сидоров Р.В. Опыт использования интракоронарных шунтов при операциях прямой реваскуляризации миокарда на работающем сердце // Вестник Национального медико-хирургического центра им. Н.И. Пирогова. – 2011. – Т. 6., № 1. – С. 16-19.
7. Хубулава Г.Г., Авалиани В.М. Защита миокарда при аортокоронарном шунтировании: современное состояние проблемы // Кардиология и сердечно-сосудистая хирургия. – 2013. – № 5. – С. 42-47.