Стабильная и нестабильная атеросклеротическая бляшка
Характеристика стабильной и нестабильной атеросклеротической бляшки
Много клеток воспаления (лимфоциты, макрофаги).
4. Реакция воспаления – причина дестабилизации атеросклеротической бляшки.
5. Маркеры воспаления – СРБ, фибриноген, SAA (serum amyloid A).
6. Холестериновое ядро активирует клетки воспаления.
7. Клетки воспаления высвобождают особые металлопротеиназы, которые вызывают разрывы бляшки (надрывы, трещины).
| Признак | Бляшка стабильная | Бляшка нестабильная |
| Гладкомышечные клетки | Много | Мало |
| Клетки воспаления | Мало | Много |
| Липидное ядро | Малое | Большое (>50% объема) |
| Металлопротеиназы | Мало | Много |
| Риск разрыва | Низкий | Высокий |
| Содержание коллагена | Много | Мало |
| Шапочка | Толстая | Тонкая |
Схема развития ИМ —разрыв или эрозия атеросклеротической бляшки, нарушение целостности эндотелия, обнажение волокон коллагена с последующей адгезией в месте повреждения тромбоцитов и формированием «тромбоцитарной губки», высвобождение в кровоток из тромбоцитов тромбоксана А2, коронароспазм, последующее наслоение эритроцитов и фибрина, быстрый рост пристеночного тромба, полная окклюзия просвета артерии, ишемия, повреждение, некроз (согласно трехзональной структуре ИМ по Бейли).
Частота поражения коронарных артерий при ИМ:
1. Нисходящая ветвь левой коронарной артерии.
2. Правая коронарная артерия.
3. Огибающая ветвь левой коронарной артерии.
4. У 33-66% больных стенозы свыше 75% наблюдаются во всех 3 магистральных артериях.
5. Поражение 1 или 2 коронарных артерий встречается одинаково часто.
Окклюзия коронарной артерии и локализация ИМ:
1. Передняя межжелудочковая коронарная артерия – передняя стенка ЛЖ, верхушка сердца, межжелудочковая перегородка, боковая стенка ЛЖ, сосочковые мышцы.
2. Огибающая ветвь левой коронарной артерии – боковая стенка ЛЖ, в том числе ее базальные отделы, задняя стенка ЛЖ, нижняя стенка ЛЖ (частично).
3. Правая коронарная артерия – нижняя стенка ЛЖ, задняя стенка ЛЖ, задние отделы межжелудочковой перегородки, заднемедиальная сосочковая мышца, правый желудочек, атрио-вентрикулярный узел, синусовый узел.
4. «Инфаркт на расстоянии» (кровоснабжение по коллатералям). Окклюзия артерии: огибающая ветвь левой коронарной артерии – ИМ передней стенки ЛЖ; левая передняя нисходящая артерия – нижний ИМ.
Классификации ИМразработаны по клинической картине, локализации, глубине поражения миокарда, периодам, течению, осложнениям, лечебной тактике. Их целесообразно рассматривать вместе с изучением клинической картины заболевания и его диагностикой.
Клинические варианты ИМ:
Ангинозная форма ИМ встречается наиболее часто (до 90% случаев). Болевой синдром, подобно симптомокомплексу стенокардии, целесообразно характеризовать по 8 признакам. Характерны необычность боли, широкий диапазон – от умеренной до очень сильной. Характеристика боли отчасти зависит от интеллекта пациента — «на грудь положили плиту», «лошадь наступила копытом», «взяли в тиски». Боли обычно длительные, более 30 минут, часто длятся часами, реже — 1-2 суток. Может быть несколько приступов, разделенных непродолжительными периодами значительного ослабления болей.
Поведение больного.Характерно возбуждение, двигательное беспокойство. Чем сильнее боль, тем более выражено стремление пациента менять позу, ходить по комнате, выбегать на балкон в поисках облегчения болей. Это является существенным отличительным признаком ИМ от стенокардии, где больной замирает («застывает, как соляной столп»).
Цереброваскулярный вариант(≈1%, встречается не только в пожилом возрасте).Преобладают симптомы нарушения мозгового кровообращения (обычно динамического). Чаще всего беспокоят обмороки, головокружения, тошнота, рвота, боли, очаговая неврологическая симптоматика. Боли нет или она очень слабая.
Астматический вариант(≈ у 20% больных, встречается чаще в пожилом возрасте). Проявляется сердечной астмой и отеком легкого. Ведущая жалоба – приступ удушья, одышки. Болей может не быть или они незначительные (остаются без внимания пациента). Так протекают чаще повторные ИМ.
Аритмический вариант.Нарушения сердечного ритма возникают почти у всех больных ИМ, однако наличие даже самых тяжелых из них само по себе не дает основания диагностировать эту форму заболевания. При данном варианте симптомы нарушения ритма доминируют. Наиболее часто развиваются пароксизмы тахикардии (желудочковой, наджелудочковой), полная АВ блокада, мерцательная аритмия (пароксизмы), АВ блокада высокой степени с выраженной желудочковой брадикардией. Характерна также гипотония, вплоть до шока (аритмогенного).
Абдоминальный (0,8%).Беспокоят боли в верхних отделах живота, правом подреберьи, диспептические расстройства (тошнота, неоднократная рвота, не приносящая облегчения, икота, вздутие живота). Иррадиация болей – лопатки, межлопаточное пространство, передние отделы грудной клетки. Возможно возникновение эрозий и острых язв в слизистой желудка. Данный вариант часто представляет диагностические трудности. Чаще встречается при нижнем ИМ.
Малосимптомный вариант (0,9%).Является своего рода исключением из общего правила. Характерен неинтенсивный болевой синдром или серия обычных, но частых приступов стенокардии, кратковременный пароксизм одышки. Такие клинические проявления не запоминаются больными. Малосимптомный вариант ИМ чаще выявляется у больных, которые часто контактируют с врачом (родственники, знакомые, в санатории, больнице и т.д.).
Периферический —иная локализация боли:лопатки, плечевые суставы, симптом «перчаток».
Данные физикального обследования.Характерны бледность кожных покровов, повышенная влажность, увеличение частоты дыханий. Наиболее часто развивается тахикардия (90-100 в 1минуту), реже частота сердечных сокращений остается нормальной и еще реже бывает брадикардия. Тахикардия во время болевого приступа и в первые часы после него не должна рассматриваться (при отсутствии других симптомов) как признак сердечной недостаточности. Она является отражением стресса. Артериальное давление в первые часы обычно повышено, реже нормальное или пониженное (главным образом за счет систолического). Ритм галопа (25-30%, пресистолический или протодиастолический) выслушивается чаще всего на фоне тахикардии и связан со значительным снижением сократительной функции левого желудочка. У 10% больных встречается эпистенотический перикардит. Симптомы перикардита чаще появляются на 2-4 сутки и могут быстро исчезать, даже через несколько часов. Чаще диагностируется при передних ИМ, чем при нижних. Развитие эпистенотического перикардита практически не влияет на прогноз заболевания. Однако, если перикардит сопровождается массивным выпотом, особенно геморрагическим, из-за сопутствующих нарушений гемодинамики вследствие тампонады сердца в остром периоде или развития слипчивого перикардита в дальнейшем прогноз значительно ухудшается. Характерно повышение температуры тела в первые несколько дней (2-7).
Все результаты лабораторных исследований у больных ИМ могут быть разделены на 3 группы:
1. Показатели, характеризующие некоторые факторы риска (атеросклероз, сахарный диабет, гиперурикемия).
2. Неспецифические показатели стрессорной реакции и резорбционно-некротического синдрома.
3. «Кардиоспецифические» показатели гибели кардиомиоцитов.
Для диагностики ИМ важны показатели 2 и 3 группы.
Лейкоцитоз.Причины:некроз, повышенная секреция глюкокортикоидов надпочечниками. Развивается через несколько часов после начала болевого синдрома, max – 2 день, снижение постепенное в течение недели. СОЭ– начинает увеличиваться на 2-3 день, max – 2 неделя, снижение постепенное, нормализация в течение 3-4 недель. Изменения лейкоцитов и СОЭ формируют симптом перекреста (или симптом ножниц).
Поскольку данные показатели лишены какой-либо органоспецифичности, они могут быть использованы для диагностики ИМ лишь при отсутствии других состояний, сопровождающихся воспалением и некрозом. Тем не менее, простота и доступность получения этих показателей сохраняют за ними важное место в кардиологической практике.
Ферменты и тропонины.Наиболее характерно повышение уровня тропонинов и МВ КФК. Меньшее значение имеет миоглобин, КФК, АСТ, АЛТ, ЛДГ. Патогномоничным для ИМ следует считать первоначальное повышение активности ферментов не менее чем на 50% выше верхней границы нормы с последующим их снижением. Сроки повышения и нормализации: КФК, МВ КФК — с первых часов, сохраняется повышенный уровень 2-3 дня, АСТ, АЛТ – с первых суток, нормализация 3-5 дней, ЛДГ (особенно ЛДГ, ЛДГ2) держится до 10-14 дней.
Дата добавления: 2014-01-05 ; Просмотров: 1738 ; Нарушение авторских прав?
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Занятие №1
Основные представления об ИБС, факторах риска, методах лечения.

Ишемическая болезнь сердца (далее — ИБС) — острое или хроническое поражение миокарда, возникающее вследствие уменьшения или прекращения снабжения сердечной мышцы артериальной кровью, в основе которого лежат патологические процессы в системе коронарных артерий.
ИБС широко распространенное заболевание. Одна из основных причин смертности, временной и стойкой утраты трудоспособности во всем мире. В структуре смертности сердечно-сосудистые заболевания стоят на первом месте, из них на долю ИБС приходится около 40%. Формы ишемической болезни сердца:
Стенокардия (стабильная и нестабильная стенокардия)
Первичный инфаркт миокарда
Повторный инфаркт миокарда
Внезапная сердечная (аритмическая) смерть
Сердечная недостаточность (поражение миокарда вследствие ИБС).

Основной причиной нарушения снабжения миокарда кислородом является несоответствие между коронарным кровотоком и и метаболическими потребностями сердечной мышцы:
атеросклероз коронарных артерий с сужением их просвета более, чем на 70%;
спазм неизмененных (малоизмененных) коронарных артерий;
нарушения микроциркуляции в миокарде;
повышение активности свертывающей системы крови или снижение активности противосвертывающей системы.

Главный этиологический фактор развития ишемической болезни сердца — атеросклероз коронарных артерий. Атеросклероз развивается последовательно, волнообразно и неуклонно. В результате накопления холестерина в стенке артерии формируется атеросклеротическая бляшка. Избыток холестерина приводит к увеличению бляшки в размере, возникают препятствия току крови. В дальнейшем, под воздействием системных неблагоприятных факторов, происходит трансформация бляшки от стабильной до нестабильной (возникают трещины и разрывы). Запускается механизм активации тромбоцитов и образования тромбов на поверхности нестабильной бляшки. Симптомы усугубляются с ростом атеросклеротической бляшки, постепенно суживающей просвет артерии. Уменьшение площади просвета артерии более чем на 90-95% является критическим, вызывает снижение коронарного кровотока и ухудшение самочувствия даже в покое.
Факторы риска ишемической болезни сердца:
Возраст >40-50 лет
Курение (10 и более сигарет в день в течение последних 5 лет)
Гиперлипидемия (общий холестерин плазмы > 240 мг/дл; холестерин ЛПНП > 160 мг/дл)

Клиническая картина ишемической болезни сердца и диагностика
Боль за грудиной, часто иррадиирует в нижнюю челюсть, шею, левое плечо, предплечье, кисть в спину; Боль давящая, сжимающая, жгучая, душащая. Интенсивность различная; Провоцируются физическими или эмоциональными факторами; В покое прекращаются самостоятельно; Длится от 30 секунд до 5-15 минут; Быстрый эффект от нитроглицерина.
«Золотым стандартом» в диагностике обструктивных поражений коронарных артерий сердца считается селективная коронарография. Применяется для того, чтобы узнать существенное ли сужение сосуда, какие артерии и сколько их поражено, в каком месте и на каком протяжении. В последнее время все большее распространение получила мультиспиральная компьютерная томография (МСКТ) с внутривенным болюсным контрастированием. В отличие, от селективной коронарографии, которая по существу является рентгенохирургическим вмешательством на артериальном русле, и выполняется только в условиях стационара, МСКТ коронарных артерий, как правило, выполняется амбулаторно с помощью внутривенного введения контрастного вещества. Еще одним принципиальным отличием может быть то, что селективная коронарография показывает просвет сосуда, а МСКТ и просвет сосуда, и, собственно, стенку сосуда, в которой локализуется патологический процесс.
Лечение ишемической болезни сердца

В зависимости от изменений в коронарных сосудах, выявленных при коронографии, могут быть предложены различные методы лечения. Лечение направлено на восстановление нормального кровоснабжения миокарда и улучшение качества жизни больных. При ИБС применяются препараты, уменьшающие работу сердца и тем самым понижающие потребность сердечной мышцы в кислороде. Это препараты, влияющие на частоту и силу сердечных сокращений. Также назначаются препараты, расширяющие периферические сосуды, тем самым уменьшающие нагрузку на сердце. Применяют следующие группы препаратов: бета-адреноблокаторы и ингибиторы АПФ, блокаторы рецепторов ангиотензина II, блокаторы кальциевых каналов, диуретики, антикоагулянты. Выбор препаратов и его дозы определяет лечащий врач!
К сожалению, чисто терапевтические методы лечения не всегда эффективны. Существует множество хирургических методов коррекции, таких как: аорто-коронарное шунтирование, трансмиокардиальная лазерная реваскуляризация миокарда и чрескожные коронарные интервеционные вмешательства (баллонная ангиопластика, стентирование коронарных артерий).
Аортокоронарное шунтирование — отработанная в течение многих лет операция, при которой берут собственный сосуд больного и подшивают к коронарной артерии. Тем самым, создается путь обхода пораженного участка артерии. Кровь в нормальном объеме поступает в миокард, что приводит к ликвидации ишемии и исчезновению приступов стенокардии. АКШ является методом выбора при ряде патологических состояний, таких как сахарный диабет, поражение ствола, многососудистое поражение и т.д. Операция может проводиться с искусственным кровообращением и кардиоплегией, на работающем сердце без искусственного кровообращения, и на работающем сердце с искусственным кровообращением. В качестве шунтов могут использоваться, как вены, так и артерии пациента. Окончательное решение о выборе того или иного вида операции зависит от конкретной ситуации и оснащенности клиники.
Популярная в свое время баллонная ангиопластика потеряла свою актуальность. Основная проблема — краткосрочность эффекта от выполненного рентгенохирургического вмешательства.
Более надежным и, в то же время, малоинвазивным методом восстановления и удержания нормального просвета сосуда, является стентирование. Метод по сути такой же, как баллонная ангиопластика, но на баллончике смонтирован стент (небольшой трансформируемый металический сетчатый каркас). При введении в место сужения, баллон со стентом раздувают до нормального диаметра сосуда, стент прижимается к стенкам и сохраняет свою форму постоянно, оставляя просвет открытым. После установки стента пациенту назначается длительная антиагрегантная терапия. В течение первых двух лет ежегодно выполняется контрольная коронарография.
В тяжелых случаях облитерирующего атеросклероза коронарных артерий, когда нет условий для АКШ и рентгенохирургических вмешательств, пациенту может быть предложена трансмиокардиальная лазерная реваскуляризация миокарда. В этом случае улучшение кровообращения миокарда происходит за счет потока крови напрямую из полости левого желудочка. На пораженную область миокарда хирург помещает лазер, создавая множество каналов диаметром менее 1 миллиметра. Каналы способствуют росту новых кровеносных сосудов, через которые кровь поступает в ишемизированный миокард, обеспечивая его кислородом. Эта операция может выполняться как самостоятельно, так и в сочетании с аортокоронарным шунтированием.
После устранения аортокоронарного стеноза заметно повышается качество жизни, восстанавливается трудоспособность, значительно снижается риск возникновения инфаркта миокарда и внезапной сердечной смерти, увеличивается продолжительность жизни.
В настоящее время диагноз ИБС это не приговор, а повод для активных действий по выбору оптимальной лечебной тактики, которая позволит сохранить жизнь на многие годы.
Стабильная и нестабильная атеросклеротическая бляшка

Атеросклероз — медленно прогрессирующее хроническое заболевание с продолжительным, на протяжении нескольких десятилетий, субклиническим периодом. Именно на этом этапе происходят те процессы, которые знаменуют переход от обратимых изменений сосудов к органическому поражению с последующим неизбежным прогрессированием и поражением органов-мишеней, запуском порочных кругов, вовлечением новых патогенетических механизмов, развитием артериальной гипертонии (АГ), коронарогенного поражения миокарда, ишемической патологии почек, головного мозга, сетчатки и других органов и тканей. Непосредственным проявлением атеросклеротического процесса являются атеросклеротические бляшки (АБ). Поскольку атеросклероз — генерализованный процесс, атеросклеротические изменения стенки в одном сосудистом бассейне отражают состояние и других региональных сосудистых бассейнов [8, 11].
Следует отметить, что субклинический атеросклероз не обязательно обозначает такое благоприятное течение процесса, при котором нет заметного роста бляшек в просвет сосудов, а также их разрывов. Известно, что к развитию острых коронарных событий нередко приводят бляшки, не создающие выраженных стенозов и, как правило, невидимые при рентгеноконтрастной ангиографии. Рано или поздно очередная такая бляшка с лопнувшей покрышкой может привести не только к клинически манифестному сердечно-сосудистому заболеванию (инфаркту миокарда, инсульту и др.), но и вызвать внезапную сердечную смерть на фоне полного, казалось бы, здоровья. Многие разрывы бляшек протекают асимптомно. В небольшом исследовании A.P. Burke et al. (2001) из 142 мужчин, умерших от внезапной сердечной смерти, у 61% были обнаружены признаки уже заживших разрывов бляшек, которые никак не проявлялись клинически.
АБ определяется как фокальная структура, выступающая в просвет артерии не менее чем на 0,5 мм или на 50% от величины ТИМ прилегающих участков артерии, или как имеющая толщину, измеренную как расстояние между линиями раздела «медиа-адвентиция» и «просвет артерии — интима» более 1,5 мм [10]. Наличие атеросклеротических бляшек в сонных артериях по данным проспективных исследований является критерием стратификации риска развития инсульта и ИБС, в ряде случаев, даже более строгим предиктором, нежели утолщение стенки [3].
Цель исследования: изучить распространенность субклинического атеросклероза по частоте обнаружения АБ в общей сонной и бедренной артериях (ОСА и БА) в изолированной социально однородной выборке мужчин, не имеющих клинических признаков атеросклероза, и оценить взаимосвязь с модифицируемыми и немодифицируемыми сердечно-сосудистыми факторами риска (ФР).
Материалы и методы исследования
Работа основана на результатах комплексного обследования состояния здоровья социально однородной группы мужчин (n = 207), проживающих в г. Кириши Ленинградской области и находящихся под диспансерном динамическом наблюдением на протяжении 10 лет. Пациенты считались пригодными для включения в исследование, если у них отсутствовали клинические проявления атеросклероза, но существовал риск их развития вследствие:
- наличия нескольких ФР (≥ 2), даже если при оценке по таблице SCORE 10-летний риск фатального исхода заболевания не превышал 5%;
- лица без клинических проявлений атеросклероза с одним умеренно выраженным ФР, например — ОХС > 5 ммоль/л, или ХСЛНП ≥ 3 ммоль/л, АД — в пределах 140/90-160/100 мм рт.ст.;
- лица с отягощенным семейным анамнезом: начало ИБС или другого сосудистого заболевания у ближайших родственников: больного по мужской линии 25 кг/м², сывороточные триглицериды ≥ 1,7 ммоль/л, ; ХС ЛПВП 5,2 ммоль/л, ГХС) была выявлена у 87%, гиперлипопротеинемия (ХС ЛПНП > 3,4 ммоль/л) — у 86%, гипо-α-холестеринемия (ХС ЛПВП 1,7 ммоль/л) — у 47% обследованных лиц. Артериальная гипертония (АГ) I-II степени была диагностирована у 26, 31% обследованных мужчин были активными курильщиками, и неблагоприятная наследственность по ССЗ выявлялась в 18% случаев.
Каждый пациент проходил углубленное медицинское обследование, включавшее сбор жалоб, врачебный осмотр, общеклинические анализы крови и мочи, биохимическое исследование крови, регистрацию ЭКГ, УЗИ сердца и внутренних органов живота, щитовидной железы, консультации специалистов (кардиолога, эндокринолога и хирурга) не реже двух раз в год.
Для оценки структурно-морфологических признаков субклинического атеросклероза использовалось УЗИ общих сонных и бедренных артерий. Диагностика проводилась по очереди двумя специалистами на аппарате Logik 400 (США). Наличие бляшки и факт существования субклинического атеросклероза устанавливали в том случае, если толщина фокальной стуктуры была не менее чем на 50% больше толщины окружающей стенки [6, 9].
Математическая обработка результатов исследования проводилась с помощью пакета прикладных статистических программ CCS «Statistica for Windows» v.6.0.437.0» (2002).
Результаты исследования и их обсуждение
Средний возраст пациентов за весь период наблюдения составил 48,7 лет. При первичном обследовании самому молодому участнику исследования было 22 года, самому старому — 64 года. Анализу были подвергнуты все наблюдения, включая повторные. Общее количество валидных наблюдений за 10-летний период времени составило 2414.
При анализе частоты выявления атеросклеротических бляшек в ОСА (табл. 1) обнаружено, что процент лиц, свободных от бляшек в измеряемых сегментах левой и правой СА, составил 78%. Одиночная бляшка хотя бы в одной из артерий регистрировалась в 8,9% случаев, 2 бляшки — в 9,1%, 3 и более бляшек — в 4,0% случаев. Таким образом, признаки субклинического атеросклероза по факту обнаружения бляшки демонстрировало 22% обследуемых лиц.
Анализ частоты выявления атеросклеротических бляшек в БА (табл. 2) показал, что процент лиц, свободных от бляшек в измеряемых сегментах левой и правой БА, составил 52,3%, что значимо меньше, чем при исследовании ОСА. Одиночная бляшка хотя бы в одной из артерий регистрировалась в 12,9% случаев, 2 бляшки — в 18,4%, 3 и более бляшек — в 16,3% случаев. Таким образом, признаки субклинического атеросклероза по факту обнаружения хотя бы одной бляшки в БА демонстрировало 46,7% наблюдений.
Таблица 1. Частота выявления атеросклеротических бляшек в ОСА за 10-летний период наблюдения
НЕСТАБИЛЬНЫЕ АТЕРОСКЛЕРОТИЧЕСКИЕ БЛЯШКИ КОРОНАРНЫХ АРТЕРИЙ У ПАЦИЕНТОВ СО СТАБИЛЬНОЙ ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА
Полный текст:
- Аннотация
- Об авторах
- Список литературы
- Cited By
Аннотация
Актуальность. Острый коронарный синдром остается ведущей причиной смерти. Патогенетическую основу острого коронарного синдрома в большинстве случаев составляет разрыв нестабильной атеросклеротической бляшки в коронарной артерии. Одной из важных задач практической кардиологии является разработка способов своевременного выявления этих бляшек с целью определения мер профилактики острого коронарного события и выбора оптимальной стратегии лечения.
Цель. Определение частоты встречаемости нестабильных бляшек в нецелевых коронарных артериях у пациентов со стабильной ишемической болезнью сердца.
Материалы и методы. В проспективное обсервационное когортное исследование включены 58 пациентов со стабильной ишемической болезнью сердца. После стентирования целевого сосуда выполнено внутрисосудистое ультразвуковое исследование с виртуальной гистологией проксимального и среднего сегментов (6–8 см) одной нецелевой артерии, в которой отсутствовали значимые стенотические поражения по данным коронарографии.
Результаты. Средний возраст пациентов – 60,4±6,6 лет. Помимо целевых гемодинамически значимых поражений, подвергнутых стентированию, у 56 пациентов выявлено 58 поражений (96,5%) в нецелевых коронарных артериях. Из них 5 поражений (8,6%) стенозировали просвет сосуда более чем на 70% по площади (в том числе из них стеноз по площади >70% + площадь просвета 70% у 2 пациентов; тонкокапсульная фиброатерома + площадь просвета 70% + площадь просвета Кочергин Никита Александрович, младший научный сотрудник лаборатории интервенционных методов диагностики и лечения. Сосновый бульвар, 6, Кемерово, 650002.
Кочергина Анастасия Михайловна, кандидат медицинских наук, научный сотрудник лаборатории патологии кровообращения ; ассистент кафедры кардиологии и сердечно-сосудистой хирургии.
Сосновый бульвар, 6, Кемерово, 650002 ; ул. Ворошилова 22а, Кемерово, 650056.
Ольга Леонидовна Барбараш, доктор медицинских наук, член-корр. РАН, директор; заведующая кафедрой кардиологии и сердечно-сосудистой хирургии.
Сосновый бульвар, 6, Кемерово, 650002 ; ул. Ворошилова 22а, Кемерово, 650056.
Список литературы
1. Lloyd-Jones D., Adams R., Carnethon M., De Simone G., Ferguson T.B., Flegal K. et al. Heart disease and stroke statistics–2009 update: a report from the American Heart Association Statistics Committee and Stroke Statistics Subcommittee. Circulation 2009; 119:480–486. doi: 10.1161/CIRCULATIONAHA.108.191261
2. Virmani R., Burke A.P., Farb A., Kolodgie F.D. Pathology of the vulnerable plaque. J Am Coll Cardiol 2006; 47:C13–C18. doi: 10.1016/j.jacc.2005.10.065
3. Корок Е.В., Сумин А.Н. Актуальные вопросы диагностики ИБС в материалах российского конгресса кардиологов (г. Екатеринбург, 20-23 сентября 2016 г.). Комплексные проблемы сердечно-сосудистых заболеваний. 2017; (1):131-140. doi:10.17802/2306-1278-2017-1-131-140
4. Glaser R., Selzer F., Faxon D.P., Laskey W.K., Cohen H.A., Slater J., Detre K.M., Wilensky R.L. Clinical progression of incidental, asymptomatic lesions discovered during culprit vessel coronary intervention. Circulation 2005; 111:143–149. doi: 10.1186/1749-8090-5-91
5. Garcia-Garcia H.M., Mintz G.S., Lerman A., Vince D.G., Margolis M.P., van Es G.A. et al. Tissue characterization using intravascular radiofrequency data analysis: recommendations for acquisition, analysis, interpretation and reporting. EuroIntervention 2009; 5:177–189. doi: 10.4244/EIJV5I2A29.
6. Kaul S., Diamond G.A. Improved prospects for IVUS in identifying vulnerable plaques? JACC Cardiovasc Imaging. 2012 Mar; 5 (3 Suppl): S106-10. doi: 10.1016/j.jcmg.2012.02.00.
7. Calvert P.A., Obaid D.R., O’Sullivan M., Shapiro L.M., McNab D., Densem C.G. et al. Association between IVUS findings and adverse outcomes in patients with coronary artery disease: the VIVA (VH-IVUS in Vulnerable Atherosclerosis) Study. JACC Cardiovasc Imag 2011; 4: 894-901. doi:10.1016/j.jcmg.2011.05.005
8. Cheng J.M., Garcia-Garcia H.M., de Boer S.P., Kardys I., Heo J.H., Akkerhuis K.M. et al. In vivo detection of high-risk coronary plaques by radiofrequency intravascular ultrasound and ardiovascular outcome: results of the ATHEROREMO-IVUS study. Eur Heart J 2014; 35: 639-47. doi: 10.1093/eurheartj/eht484
9. Sinclair H., Veerasamy M., Bourantas C., Egred M., Nair A., Calvert P.A., Brugaletta S., Mintz G.S., Kunadian V. The Role of Virtual Histology Intravascular Ultrasound in the Identification of Coronary Artery Plaque Vulnerability in Acute Coronary Syndromes. Cardiology in Review 2016; 24(6): 303-309, doi: 10.1097/CRD.0000000000000100.
10. Stone G.W., Maehara A., Lansky A.J., de Bruyne B., Cristea E., Mintz G.S., et al. A prospective natural-history study of coronary atherosclerosis. N Engl J Med 2011; 364:226–235. doi: 10.1056/NEJMoa1002358
11. Battes L.C., Cheng J.M., Oemrawsingh R.M., Boersma E., Garcia-Garcia H.M., de Boer S.P. et al. Circulating cytokines in relation to the extent and composition of coronary atherosclerosis: results from the ATHEROREMO-IVUS study. Atherosclerosis 2014; 236: 18-24. doi: 10.1016/j.atherosclerosis.2014.06.010
12. Cheng J.M., Oemrawsingh R.M., Garcia-Garcia H.M., Akkerhuis K.M., Kardys I., de Boer S.P. et al. Relation of C-Reactive Protein to Coronary Plaque Characteristics on Grayscale, Radiofrequency Intravascular Ultrasound, and Cardiovascular Outcome in Patients With Acute Coronary Syndrome or Stable Angina Pectoris (from the ATHEROREMO-IVUS Study). Am J Cardiol 2014; 114: 1497-503. doi: 10.1016/j.amjcard.2014.08.013
Для цитирования:
Кочергин Н.А., Кочергина А.М., Ганюков В.И., Барбараш О.Л. НЕСТАБИЛЬНЫЕ АТЕРОСКЛЕРОТИЧЕСКИЕ БЛЯШКИ КОРОНАРНЫХ АРТЕРИЙ У ПАЦИЕНТОВ СО СТАБИЛЬНОЙ ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА. Комплексные проблемы сердечно-сосудистых заболеваний. 2018;7(3):65-71. https://doi.org/10.17802/2306-1278-2018-7-3-65-71
For citation:
Kochergin N.A., Kochergina A.M., Ganjukov V.I., Barbarash O.L. VULNERABLE ATHEROSCLEROTIC PLAQUES OF CORONARY ARTERIES IN PATIENTS WITH STABLE CORONARY ARTERY DISEASE. Complex Issues of Cardiovascular Diseases. 2018;7(3):65-71. (In Russ.) https://doi.org/10.17802/2306-1278-2018-7-3-65-71

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Интервенционные методы в лечении сердечно-сосудистых заболеваний
Стельмашок Виталий Иванович, заведующий лабораторией неотложной и интервенционной кардиологии РНПЦ «Кардиология», кандидат медицинских наук
В настоящее время сердечно-сосудистые заболевания являются основными причинами смертности населения в развитых странах мира. К сожалению, Республика Беларусь здесь не является исключением: так, согласно данным статистической отчетности, в нашей стране сердечно-сосудистая патология является абсолютным лидером по вкладу в показатель общей смертности — более половины от общего числа летальных исходов случаются по причине болезней системы кровообращения.
Ишемическая болезнь сердца относится к числу наиболее значимых сердечно-сосудистых заболеваний — на долю ее различных форм приходится приблизительно 2/3 смертей от общего числа летальных исходов по причине сердечно-сосудистых заболеваний. Суть ишемической болезни сердца состоит в том, что в коронарных артериях, кровоснабжающих сердечную мышцу, вследствие прогрессирования атеросклероза происходит рост и развитие атеросклеротических бляшек. При наличии стабильных бляшек происходит постепенный их рост, приводящий к сужению просвета артерии (см. рис. 1), к нарушению кровотока по данной артерии и к кислородному голоданию (ишемии) находящихся в зоне кровоснабжения данной артерии органов и тканей. Клинически это проявляется наличием стабильной стенокардии различной степени тяжести.
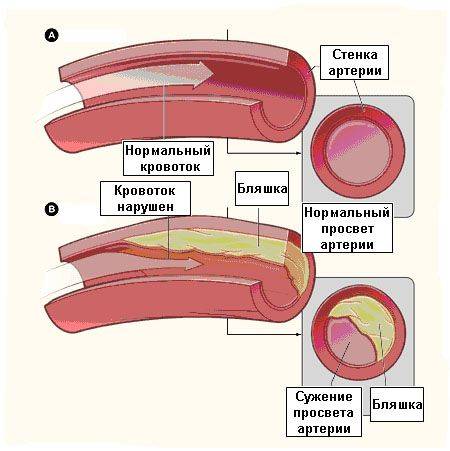 |
Рис. 1. Непораженная коронарная артерия (а), стабильная атеросклеротическая бляшка (б), вызывающая сужение просвета сосуда
В свою очередь, нестабильные атеросклеротические бляшки являются «ранимыми», склонными к разрыву, что ведет к появлению тромба на поверхности разорвавшейся атеросклеротической бляшки (см. рис. 2), к острому нарушению кровотока по данной артерии, что клинически проявляется развитием нестабильной стенокардии или же инфаркта миокарда.
Несмотря на значительные успехи медикаментозной терапии, применяемой для лечения пациентов, страдающих ишемической болезнью сердца, данный вид лечения не всегда способен в полной мере решить поставленные задачи, которые заключаются в улучшении качества (то есть уменьшение тяжести и числа эпизодов стенокардии) и в увеличении продолжительности жизни пациентов. В данных случаях на помощь медикаментозной терапии приходят интервенционные и хирургические методы лечения данного заболевания.
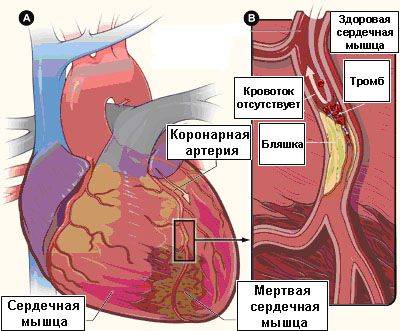 |
Рис. 2. Сердце (а), разорвавшаяся нестабильная атеросклеротическая бляшка с тромбом на ее поверхности (б),
приводящие к прекращение кровотока за зоной бляшки и к развитию омертвения части сердечной мышцы
В том случае, когда планируется хирургическое или интервенционное вмешательство у больного, страдающего ишемической болезнью сердца, необходимо проведение специального инвазивного исследования, называемого коронарографией. Данная процедура нужна для того, чтобы точно оценить характер поражения коронарных артерий, что позволит выбрать наиболее оптимальную тактику дальнейшего лечения — выполнение малоинвазивных вмешательств, таких как чрескожная баллонная ангиопластика/стентирование коронарных артерий или же «большой» операции — аортокоронарного шунтирования. Следует отметить, что проведение коронарографии особенно необходимо пациентам с ишемической болезнью сердца, у которых имел место перенесенный инфаркт, или же стенокардия плохо поддается медикаментозному лечению.
Процедура коронарографии выполняется под местной анестезией, после которой проводится пункция крупной магистральной артерии на ноге или же на руке. Затем в пунктированную артерию устанавливается специальная трубка — интрадьюсер, через которую в аорту, а затем в устье коронарных артерий проводятся специальные катетеры. Через данные катетеры в артерии сердца вводят специальное рентгеноконтрастное вещество, которое током крови разносится по коронарным сосудам, и делает их видимыми для специальной установки — ангиографа, который показывает весь результат на экране монитора. Поэтому, где, как и насколько поражены сосуды сердца, видно очень хорошо. Особо следует отметить, что во время процедуры пациент не чувствует никаких болевых ощущений (в сосудах нет болевых рецепторов), находится в сознании и может наблюдать за картиной его собственных коронарных артерий, выводимых на монитор ангиографического аппарата. Процедуры коронарографии, а также других диагностических и лечебных миниинвазивных вмешательств на сосудах выполняются специальными врачами — рентгенэндоваскулярными хирургами.
Бояться коронарографии не стоит — это важная диагностическая процедура. В некоторых случаях, крайне редко, возможны осложнения (нарушение ритма сердца, аллергия на контрастное вещество, тромбоз артерии и т.д.), но они всегда поддаются экстренной помощи.
Ангиопластика и стентирование коронарных артерий — самые щадящие методы хирургического лечения суженных сосудов. Данная процедура, как и коронарография, является безболезненной и проводится под местной анестезией (пациент находится в сознании). В настоящее время ежегодно во всем мире выполняется более 2 млн. подобных процедур.
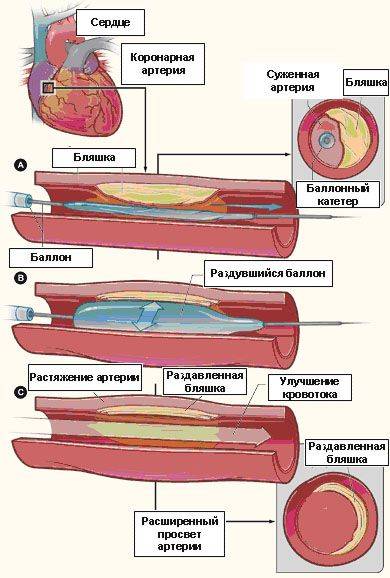 |
Рис. 3. Нерасправленный баллонные катетер позиционирован в зоне сужения коронарной артерии (а), раздутие баллона,
приводящее к фрагментации бляшки (б), полное восстановление проходимости коронарной артерии (с)
Начинается процедура ангиопластики/стентирования коронарных артерий с проведения под рентгеновским контролем и установке в устье коронарной артерии особого инструмента — направляющего катетера. После того, как направляющий катетер установлен в устье коронарной артерии, по нему в сосуд проводится тонкий проводник диаметром около 0,35 мм, таким образом, что его кончик находится за зоной сужения. Затем в сосуд по проводнику вводится специальный баллонный катетер, который позиционируется в зоне сужения сосуда. После этого врач раздувает баллон (обычно до 10-14 атмосфер) в течение 20-30 сек, и просвет сосуда расширяется, после чего баллонный катетер сдувается и извлекается из просвета сосуда (см. рис. 3).
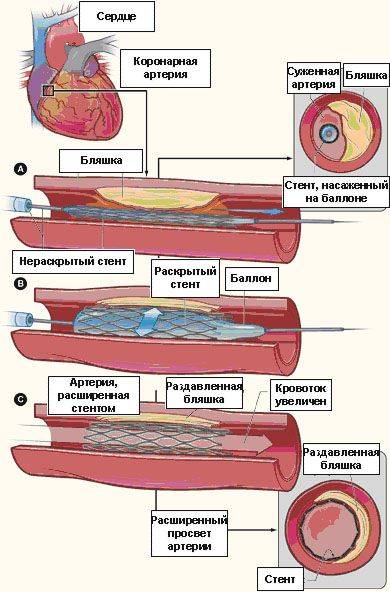 |
Рис. 4. Насаженный на баллоне стент позиционирован в зоне сужения коронарной артерии (а),
раздутие баллона с имплантацией стента (б), полное восстановление проходимости коронарной артерии (с)
С целью предупреждения развития повторного сужения леченного сосуда (рестеноза) рентгенэндоваскулярный хирург практически всегда после удаления баллонного катетера устанавливает в расширенное место сосуда стент — проволочную конструкцию цилиндрической формы, служащую каркасом для данного участка артерии. Коронарный стент насажен на баллон, который находится в нераскрытом состоянии, и в таком виде по проводнику проводится к пораженному месту артерии. После того, как врач четко выполнит позиционирование стента в нужном участке сосуда, производится раздутие баллона, на котором насажен стент (обычно до 12-20 атмосфер), в процессе которого стент расширяется и плотно прижимается к сосудистой стенке (см. рис. 4). Затем врач сдувает баллон и удаляет его из сосуда, а раскрывшийся стент остается в просвете сосуда пожизненно. Заканчивается процедура ангиопластики/стентирования коронарных артерий удалением проводника, катетера и интрадьюсера из сосудистого русла. Место прокола сосуда прижимается для остановки кровотечения либо закрывается при помощи специальных устройств. В среднем длительность процедуры ангиопластики/стентирования коронарных артерий занимает от 45 минут до 3 часов.
Однако даже стентирование не дает стопроцентной гарантии исключения рестеноза. Дело в том, что со временем стент обрастает соединительной тканью и вновь происходить сужение просвета артерии. Поэтому в тех случаях, когда у пациента ожидаемо высокий риск развития рестеноза, имплантируются специальные стенты с лекарственным покрытием, выделяющие антипролиферативные препараты, которые подавляют рост соединительнотканных компонентов.
Следует также помнить о том, что после процедуры ангиопластики/стентирования коронарных артерий пациент должен постоянно принимать специальную терапию. Во-первых, это касается антитромбоцитарных препаратов, способствующих разжижению крови: аспирин — постоянно и клопидогрель в течение 1-12 месяцев. В случае имплантации стентов с покрытием, выделяющими антипролиферативные препараты, длительность приема клопидогреля увеличивается до 12-24 месяцев. Помимо вышеуказанного, необходимо пожизненно принимать статины (препараты, снижающие уровень холестерина) — это является надежным методом профилактики роста атеросклеротических бляшек в других участках коронарных артерий. Также необходимо принимать медикаментозную терапию, предназначенную для лечения ишемической болезни сердца и, при необходимости, лекарства, снижающие артериальное давление. Регулярный и правильный прием медикаментозной терапии под контролем врача-кардиолога — залог успеха на будущее.
Однако не следует полагать, что проведение процедуры ангиопластики/стентирования возможно только в пораженных атеросклерозом артериях сердца. В настоящее время разработаны и успешно применяются специальные баллонные катетеры и стенты для лечения пораженных атеросклерозом сонных артерий, почечных артерий, висцеральных артерий и артерий нижних конечностей; специальные протезы (стент-графты) используются для лечения аневризм аорты. Широко в клинической практике применяются различного типа окклюдеры, которые нужны для устранения врожденных дефектов межпредсердной и межжелудочковой перегородок сердца; разрабатываются специальные клапаны, которые в будущем можно будет имплантировать миниинвазивно, без остановки сердца, что позволит избежать выполнения «большой» операции у некоторых пациентов, страдающих пороками сердца. Уже сейчас с большой долей вероятности можно утверждать, что в последующие годы показания к применению интервенционных методов для лечения сердечно-сосудистых заболеваний будут только расширяться, а данные процедуры проводиться все чаще и чаще.
На сегодняшний день в Республике Беларусь головным учреждением, где происходит разработка и внедрение новых интервенционных методов в клиническую практику для лечения больных с сердечно-сосудистой патологией, является Республиканский научно-практический центр «Кардиология». Высококвалифицированный персонал работающих в центре врачей рентгенэндоваскулярных хирургов выполняет сложные и высокотехнологичные миниинвазивные диагностические и лечебные процедуры на сердце и сосудах на высоком профессиональном уровне с хорошими ближайшими и отдаленными результатами.
220036, Республика Беларусь, г. Минск, ул. Р. Люксембург, 110Б
Ишемическая болезнь сердца
Ишемическая болезнь сердца (ИБС) включает в себя все состояния ишемии миокарда независимо от патомеханизма.
Коронарная болезнь (КБ) включает в себя состояния ишемии миокарда, связанные с изменениями в коронарных артериях.
1. Классификация коронарной болезни
1) стабильные коронарные синдромы (хроническая коронарная болезнь):
а) стабильная стенокардия;
б) микроваскулярная стенокардия;
в) стенокардия, вызванная мышечными мостиками над коронарными артериями;
г) вазоспастическая стенокардия (син. вариантная, Принцметала);
2) острые коронарные синдромы (ОКС).
2. Классификация ОКС с учетом исходной ЭКГ
1) ОКС без подъема сегмента ST;
2) ОКС с подъемом сегмента ST.
3. Классификация ОКС с учётом клинической картины, биохимических маркеров повреждения миокарда и ЭКГ
1) нестабильная стенокардия ( unstable angina — UA);
2) инфаркт миокарда без подъема сегмента ST ( nonST elevation myocardial infarction — NSTEMI);
3) инфаркт миокарда с подъемом сегмента ST ( ST elevation myocardial infarction — STEMI);
4) инфаркт миокарда неклассифицированный — изменения на ЭКГ не позволяют однозначно утверждать о подъеме ST: блокада левой ножки пучка Гиса (острая или присутствовавшая ранее), ритм кардиостимулятора или случаи, когда инфаркт диагностирован на основании клинических и биохимических критериев, но ЭКГ сделано через >24 ч от появления симптомов;
5) внезапная сердечная смерть.
4. Классификация инфаркта миокарда на основании эволюции ЭКГ картины
1) инфаркт миокарда без зубца Q;
2) инфаркт миокарда с зубцом Q;
5. Клиническая классификация инфаркта миокарда
1) тип 1 — спонтанный инфаркт миокарда, развившийся вследствие ишемии, вызванной первичным коронарным событием, возникшим в результате эрозии, разрыва или расслоения атеросклеротической бляшки; присутствуют критерии ОКС, рекомендации — как при ОКС;
2) тип 2 — вторичный инфаркт миокарда, ишемия в результате увеличения потребления или снижения поступления кислорода (самые частые причины: аритмия, артериальная гипертензия, гипотензия, анемия, спазм коронарной артерии); чаще всего это NSTEMI. В сравнении с инфарктом 1 типа, чаще развивается у пожилых лиц, с сопутствующими заболеваниями, имеется более высокий риск осложнений (оцениваемых с помощью шкал риска), а также худший кратко- и долгосрочный прогноз. Тактика при инфаркте 2 типа основывается прежде всего на ликвидации либо ограничении влияния факторов, нарушающих равновесие между потребностью миокарда в кислороде и его доставкой.
3) тип 3 — внезапная сердечная смерть (смерть наступила до момента забора крови или до повышения уровня сердечных биомаркеров в крови);
4) тип 4а — инфаркт миокарда, связанный с ЧКВ; тип 4б — инфаркт миокарда, вызванный тромбозом стента; тип 4в — инфаркт миокарда, связанный с рестенозом;
5) тип 5 — инфаркт миокарда, связанный с АКШ.
ЭТИОЛОГИЯ и ПАТОГЕНЕЗ наверх
1) самая частая (>98 %) — атеросклероз коронарных артерий;
2) редко — спазм коронарной артерии (вариантная стенокардия, спазм, спровоцированный ЛС [напр., 5-фторурацил], другими факторами [напр., кокаин] или отменой нитратов), эмболия коронарной артерии, коронариит, изменения в коронарных артериях, вызванные нарушениями метаболизма, анатомические дефекты коронарных сосудов, травма коронарной артерии, артериальный тромбоз при нарушениях гемостаза, снижение поступления кислорода по отношению к потреблению (стеноз и недостаточность аортального клапана, гипертрофическая кардиомиопатия, отравление угарным газом, тиреотоксикоз, длительная гипотензия, анемия, мышечные мостики), расслоение аорты;
3) микрососудистая дисфункция (коронарный синдром Х).
2. Причина стабильной стенокардии: чаще всего, стеноз эпикардиальной коронарной артерии атеросклеротической бляшкой. Классификация стенозов эпикардиальных артерий:
1) несущественный стеноз — сужение диаметра просвета артерии на гемодинамически значимый стеноз, субкритический — возможна ограниченная адаптация коронарного кровотока к энергетическим потребностям, но при дальнейшем увеличении нагрузки (физическая нагрузка или нагрузка, спровоцированная фармакологически, напр., добутамином) появляются симптомы стенокардии;
3) критический стеноз — просвет артерии сужен на >80 %, а площадь поперечного сечения на >90 %; симптомы ишемии миокарда наблюдаются в состоянии покоя.
3. Причины ОКС: нарушение баланса между потребностью миокарда в кислороде и его поступлением, возникающее, чаще всего, в результате острого сужения коронарной артерии тромбом, образовавшимся на поверхности поврежденной атеросклеротической бляшки:
1) нестабильная стенокардия — чаще всего в результате повреждения эксцентричной атеросклеротической бляшки; тромб ограничивает коронарный кровоток, но полностью его не блокирует;
2) инфаркт миокарда с подъемом сегмента ST — как правило, тромб полностью и внезапно перекрывает просвет коронарной артерии. Некроз начинает развиваться в течение 15–30 мин от прекращения кровоснабжения и продвигается от субэндокардиального слоя к эпикарду. Время, за которое развивается некроз, зависит от диаметра пораженного сосуда и коллатерального кровоснабжения.
3) инфаркт миокарда без подъема сегмента ST — часто является следствием нестабильной стенокардии. Зона инфаркта обычно имеет достаточно хорошо развитое коллатеральное кровоснабжение или имеет небольшие размеры (то есть, кровоснабжается из дистальных отделов коронарной артерии).



