Серповидноклеточная анемия человека симптомы и лечение
Серповидно-клеточная анемия. Причины, симптомы, диагностика и лечение серповидно-клеточной анемии.
- простуда
- головокружение
- тошнота
1. Что такое серповидно-клеточная анемия и ее причины
Серповидно-клеточная анемия – это наследственное заболевание крови. Попробуем разобраться, в чем же оно заключается. Эритроциты крови содержат гемоглобин – белок, который переносит кислород в крови. В норме эритроциты имеют круглую форму и они гибкие, что позволяет им двигаться через мелкие кровеносные сосуды, чтобы доставить кислород ко всем частям тела.
Серповидно-клеточная анемия заставляет клетки крови принимать форму полумесяца, или серпа. В такой форме клеток крови эритроциты очень легко распадаются, что вызывает анемию. Серповидные красные клетки живут всего 10-20 дней вместо 120 дней, как бывает в норме у здоровых клеток. Кроме того, поврежденные эритроциты слипаются и прилипают к стенкам кровеносных сосудов, блокируя поток крови. Это может стать причиной сильных болей и постоянного повреждения мозга, сердца, легких, почек, печени, костей и селезенки.
Причины серповидно-клеточной анемии
Серповидно-клеточная анемия человека вызывается генетической аномалией в гене гемоглобина. Эта аномалия приводит к появлению серповидного гемоглобина. Когда кислород высвобождается от серповидного гемоглобина, он склеивается и образует длинные стержни, которые повреждают эритроцит и изменяют его форму. Серповидные эритроциты и вызывают симптомы серповидно-клеточной анемии.
Серповидно-клеточная анемия человека не заразна. Это генетическое заболевание, с которым рождается человек. Заболевание развивается, когда ребенок наследует два аномальных гена гемоглобина, по одному от каждого из родителей. Люди, которые унаследовали только один аномальный ген гемоглобина, являются его носителями, но у них не будет анемии и симптомов этого заболевания.
2. Симптомы заболевания
Симптомами серповидно-клеточной анемии могут быть:
- Сильные боли;
- Анемия;
- Боль в груди и затрудненное дыхание;
- Боль в суставах, артрит;
- Закупорка кровотока в селезенке или печени;
- Тяжелые инфекции.
У больных серповидно-клеточной анемией развивается тяжелая боль в груди, спине, руках, ногах и животе. Кроме того, боль может возникать в любой части тела. Серповидные красные кровяные клетки в легких могут вызвать серьезные заболевания с такими симптомами, как боль в груди, лихорадка и затрудненное дыхание. Серповидно-клеточная анемия может привести и к необратимым повреждениям мозга, сердца, почек, печени, селезенки и костей. Ососбенность этого заболевания в том, что тяжесть и симптомы болезни могут сильно отличаться у разных людей, даже если они являются кровными родственниками.
3. Диагностика серповидно-клеточной анемии
Серповидные эритроциты можно увидеть, когда образец крови исследуется под микроскопом. Но для диагностики серповидно-клеточной анемии человека используется специальный анализ крови – гемоглобин-электрофорез, который позволяет измерить количество аномального гемоглобина. В зависимости от установленного количества серповидного гемоглобина можно определить, является ли человек носителем гена или имеет заболевание серповидно-клеточную анемию.
Есть и быстрые скрининг-тесты, которые помогают выявить серповидные эритроциты или сгустки аномального гемоглобина, когда кислород выходит из крови. Но эти тесты применяются редко, потому что они не позволяют отличить заболевание и простое наличие гена болезни.
Перинатальная диагностика серповидно-клеточной анемии проводится путем изучения ДНК клеток плода, полученных при биопсии хориона или амниоцентеза.
4. Лечение болезни
Для лечения серповидно-клеточной анемии человека применяются:
- Опиоидные обезболивающие (например, морфин);
- Противовоспалительные препараты (например, ибупрофен);
- Антибиотики для лечения инфекций;
- Кислород;
- Внутривенное или пероральное введение специальных жидкостей.
Переливание эритроцитов может понадобиться в случае тяжелой анемии, для профилактики приступов стенокардии или перед операцией. Иногда обменное переливание осуществляется с помощью специального аппарата, который удаляет серповидные красные кровяные клетки и заменяет их на здоровые.
Для лечения серповидно-клеточной анемии может назначаться специальный препарат – гидроксимочевина. Он помогает предотвратить приступы боли. Исследования показали, что при регулярном приеме гидроксимочевины у больных серповидно-клеточной анемией уменьшается частота и тяжесть приступов боли, а также сокращается количество необходимых переливаний крови и госпитализаций.
Единственным способом действительно вылечить серповидно-клеточную анемию человека является пересадка стволовых клеток. Это достаточно новый метод лечения. Он сопряжен с серьезными рисками (около 5-10% риск смертельного исхода), но те пациенты, трансплантация стволовых клеток у которых прошла успешно, полностью вылечились от серповидно-клеточной анемии.
Пересадка стволовых клеток обычно делается молодым пациентам с тяжелой серповидно- клеточной анемией, для которых удается подобрать подходящего донора. Иногда для трансплантации стволовых клеток используется пуповинная кровь от донора-родственника.
Важно и то, что ученые постоянно изучают возможность лечения серповидно-клеточной анемии человека с помощью новых препаратов, которые предотвращают выработку серповидно- клеточных эритроцитов красных кровяных клеток и улучшают кровоток и доставку кислорода к органам и тканям. И эти новые методы лечения уже довольно успешно проходят тестовые испытания.
Вообще люди с серповидно-клеточной анемией, как правило, имеют меньшую продолжительность жизни. Но современная медицина показывает неплохие результаты. Современные методики лечения позволяют существенно продлить жизнь таким пациентам.В 1973 году средняя продолжительность жизни людей с серповидно-клеточной анемией была 14 лет, а сегодня цифра 40-50 лет является вполне реальной. Бывает, что пациенты живут 60 лет и дольше. Постоянное лечение гидроксимочевиной может продлить жизнь.
Серповидноклеточную анемию научились лечить с помощью CRISPR

Ученые из Университета Калифорнии испытали на мышах метод генетической терапии серповидноклеточной анемии, использующий технологию CRISPR/Cas9. Результаты испытаний говорят о том, что внесенные в геном изменения действительно сохраняются на протяжении длительного времени. Однако пока эффективность внесения генетических «поправок» достаточно низкая, а безопасность терапии даже не исследовалась. Работа опубликована в журнале Science Translation Medicine.
Серповидно-клеточная анемия — одно из наиболее хорошо изученных генетических заболеваний. Она вызывается одиночной мутацией в последовательности одного из белков, входящих в состав гемоглобина — бета-глобина (обычный гемоглобин это тетрамер из двух альфа- и двух бета-глобинов, каждый из которых снабжен небелковым кофактором, гемом). Замена аминокислоты глутамата на валин в первичной последовательности бета-глобина приводит к тому, что получившийся гемоглобин становится «липким» и начинает образовывать агрегаты внутри красных кровяных телец. Это приводит к тому, что эритроциты приобретают вытянутую форму, благодаря которой болезнь и получила свое название.
Серповидные эритроциты часто скапливаются в местах разветвления кровеносных сосудов и могут формировать тромбы, приводящие к остановке кровоснабжения и даже отмиранию тканей. Кроме того, такие эритроциты чаще разрушаются, что вызывает анемию и приводит к проблемам с иммунитетом. В целом серповидноклеточная анемия снижает ожидаемую продолжительность жизни человека примерно на 30 лет. Несмотря на то, что патологические процессы, связанные с развитием этого заболевания, хорошо изучены, у медиков сейчас нет почти никаких механизмов ее реальной терапии. Единственным сколько-нибудь эффективным методом вмешательства является пересадка кроветворных клеток от донора вместе с костным мозгом, однако она сама по себе опасна для иммунной системы, не говоря уже о проблемах поиска подходящего донора.
Серповидноклеточная анемия, однако, является удобной мишенью для генетической терапии. Дело в том, что в данном случае не требуется замены мутантной последовательности во всех клетках организма пациента (как, например, при попытке удаления ВИЧ из генома). Достаточно точечного воздействия на стволовые кроветворные клетки, причем не обязательно на все 100 процентов их популяции. Даже если часть из них станет производить нормальный бета-глобин, эритроциты, получившиеся из таких клеток, за счет повышенного времени своей жизни должны купировать основные симптомы болезни.
Некоторые исследовательские группы уже пробовали применять генетическую терапию для лечения этого заболевания. Так, о первых успехах в прошлом году заявили ученые в журнале Blood. Однако тогда для внесения «правильных» мутаций авторы статьи использовали так называемые нуклеазы на цинковых пальцах, или ZFN-белки (их специально разрабатывают in silico под каждую исследуемую мутацию). И эффективность процесса была невелика: в костном мозгу мышей сохранялось всего около одного процента «правильных» кровяных клеток. В новой работе исследователи обратились к более современной технологии CRISPR/Cas9, которая сейчас начинает активно испытываться в медицине.
Кратко эксперимент выглядел следующим образом. Ученые взяли линию клеток, напоминающих стволовые клетки крови (гемобластоцисты), и ввели в них с помощью электрического тока специальный препарат. Он представлял собой рибонуклеопротеин: комплекс белка-нуклеазы Cas9, направляющей РНК и правильной версии гена. Проникая в клетку, нуклеаза разрезала ген бета-глобина недалеко от патогенной мутации, а затем собственные ферменты клетки залечивали разрыв, используя образец ДНК из препарата. Эффективность процесса редактирования зависит от множества факторов: не только конкретной направляющей РНК и мишени, но и от ДНК-образца. И значительная часть описываемой работы была посвящена как раз подбору условий максимально эффективного внесения мутаций. В результате авторам удалось добиться того, что около трети от обработанных клеток были «исправлены» на генетическом уровне. Однако основная часть работы заключалась в том, что эти клетки инъецировали в кровоток мышей и следили за тем, как они себя ведут и насколько долго могут сохраниться (использовались мыши специальной линии, которые не вырабатывают иммунную реакцию на человеческие клетки).
Главный положительный результат работы заключается в том, что кроветворные клетки с измененным геномом обнаруживались в костном мозге мышей даже спустя несколько месяцев после терапии. Для грызунов, которые живут не более двух лет, этот результат можно считать очень хорошим. С другой стороны, «правильные» кроветворные клетки составляли всего два процента от общей популяции. По словам авторов, даже этого достаточно, чтобы привести к значимому терапевтическому эффекту (и это в два раза больше, чем в предыдущей работе с ZFN-нуклеазами). Однако до начала клинических испытаний ученые планируют поднять эту долю хотя бы до пяти процентов. После этого планируется исследовать побочную активность нуклеаз, т. е. возможность внесения разрывов в других участках генома. Опасность таких разрывов в терапевтических применениях CRISPR/Cas9 пока практически не исследована. Только после завершения двух этих этапов можно будет говорить о клинических испытаниях технологии.
Серповидноклеточная анемия — только один из примеров ближайших целей генетической терапии с помощью CRISPR/Cas9. Так, уже ведутся исследования возможности терапии другого наследственного заболевания, талассемии (которая также связана с мутацией в бета-глобине). Именно это заболевание было мишенью при редактировании первого эмбрионального генома китайской группой в начале прошлого года. Другой пример — диодистрофия Дюшена, терапия которой уже испытана на мышах. Большие надежды биоинженеры возлагают на сочетание технологии CRISPR/Cas9 и метода химерных антигенных рецепторов — эти исследования стали первыми исследованиями такого рода, одобренными американским регулятором FDA. Более сложной целью можно считать применение CRISPR для удаления ВИЧ, интегрированного в клеточный геном хозяина. Это, скорее всего, потребует существенного прогресса в эффективности генетического редактирования, однако такие эксперименты уже проводятся, в том числе на лабораторных животных. Об основах метода генетического редактирования CRISPR/Cas9 можно прочитать здесь, о последних трендах в этой области — здесь.
Генная терапия серповидно-клеточной анемии у подростков с использованием лентивирусного вектора
В статье New England Journal of Medicine от 2 марта 2017 года опубликован клинический случай об успешном лечении пациента с тяжелой формой серповидно-клеточной анемией (СКА) посредством генной терапии.
Серповидноклеточная анемия является одним из наиболее распространенных наследственных моногенных заболеваний. Около 90 000 человек в Соединенных Штатах страдают серповидноклеточной анемией, а во всем мире более 275 000 детей ежегодно рождаются с данным заболеванием.
СКА – это заболевание в основе, которого лежит изменение формы эритроцитов, вследствие появления патологического гемоглобина S (HbS), в результате точечной мутации в гене β-цепи гемоглобина
Клиническими проявлениями являются вазоокклюзионные кризы в жизненно важных органах. Что в итоге приводит к необратимому поражению органов, низкому качеству жизни, сокращению продолжительности жизни и даже к смерти.
Основным методом лечения, является использование препарата гидроксимочевины, механизм действия которой заключается в повышение уровня фетального гемоглобина. У многих пациентов использование гидроксимочевины, является единственным методом терапии, облегчающей проявления заболевания.
Аллогенная трансплантация, в настоящее время, это единственный метод терапии для пациентов с тяжелой формой СКА. Однако, менее 18% пациентов имеют полностью совместимого донора-сиблинга.
Использование генной терапии у пациентов с СКА, может обеспечить длительную клиническую ремиссию.
Ранее, были сообщения об эффективном лечении СКА у мышей, посредством генной терапии с использованием вирусного вектора. В данной статье, рассмотрены результаты успешного лечения пациента, который получил генную терапию в клиническом исследовании HGB-205.
Диагноз: тяжелая форма СКА, с генотипом βS / βS (точечная делеция гена 3.7 kb α-глобина)
Клинические проявления: многочисленные вазооклюзионные кризы, эпизода стенокардии, двусторонний остеонекроз тазобедренных суставов.
Операции: холецистэктомия и спленэктомия.
Лечение: с 2 до 9 лет получал терапию гидроксимочевинной, клинические симптомы оставались прежние. С 2010 года мальчик получал лечение хелатированным железом в дозе 17 мг/кг в сутки.
В октябре 2014 г применена генная терапия с использованием лентивирусного вектора.
Лентивирусный вектор, кодирующий ген βA-глобин человека, подобно гамма-глобину, субъединице фетального гемоглобина, гасит полимеризацию HbS.
Пациенту выполнено миелоаблативное кондиционирование с использованием бусульфана.
После 2-х дневного перерыва реинфузия аутологичных трансдуцированных CD34+ клеток (5,6 × 106/кг МТ CD34+).
Заместительные гемотрансфузии продолжались, пока содержание HbA не составило от 25 до 30% от общего содержания гемоглобина.
Основные лабораторные показатели до генной терапии (при скрининге) и через 3-месячные интервалы после переливания трансдуцированных аутологичных CD34+ клеток
Норма
Скрининг*
Анемия
Недостаток в крови здоровых эритроцитов – клеток, доставляющих достаточное количество кислорода к тканям организма. Анемия может быть временной или хронической, может варьироваться от легкой до тяжелой формы.
В некоторых случаях может быть предупреждающим признаком серьезного заболевания.
Виды и причины
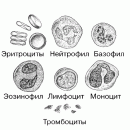
Эритроциты регулярно вырабатываются костным мозгом, для этого организму необходимы железо, витамин B-12, фолиевая кислота и другие питательные вещества.
Недостаток эритроцитов в крови может быть следствием:
Снижения выработки красных кровяных телец организмом;
Быстрой гибели эритроцитов в организме.
Существует множество видов анемии, каждая из которых имеет свою этиологическую причину.
Железодефицитная анемия. Этот наиболее распространенный тип анемии, часто встречается у беременных женщин, бывает вызван кровопотерей или наличием некоторых хронических состояний, связанных с частыми кровотечениями.
Витамин В12-дефицитная анемия. Для выработки достаточного количества здоровых эритроцитов необходимы фолиевая кислота и витамин B12. Диета, в которой отсутствуют эти и другие ключевые питательные вещества, может привести к снижению выработки красных кровяных телец. Кроме того, необходимо, чтобы витамин усваивался организмом, в противном случае есть риск развития пернициозной анемии.
Анемия хронического воспаления. Некоторые заболевания, такие как рак, ВИЧ, ревматоидный артрит, заболевание почек, болезнь Крона и другие острые или хронические воспалительные заболевания, могут влиять на выработку эритроцитов.
Апластическая анемия. Эта редкая, опасная для жизни анемия возникает, когда ваш организм не производит достаточно красных кровяных телец. Причины апластической анемии включают инфекции, аутоиммунные заболевания и воздействие токсичных химических веществ.
Анемия, вызванная заболеваниями костного мозга. Различные заболевания, такие как лейкемия и миелофиброз, могут вызывать анемию, влияя на выработку эритроцитов в костном мозге.
Гемолитическая анемия. Развивается, когда эритроциты разрушаются быстрее, чем костный мозг их вырабатывает. Некоторые заболевания способствуют ускоренному гемолизу. Гемолитическая анемия может быть наследственной или приобретенной.
Серповидно—клеточная анемия. Наследственное заболевание; проявляется изменением формы эритроцитов в виде серпа, и вызывает развитие хронической анемии.
Факторы риска
Несбалансированная диета с низким содержанием железа, витамина B-12 и фолиевой кислоты.
Заболевания системы ЖКТ. Наличие кишечного расстройства, которое влияет на всасывание питательных веществ в тонкой кишке — например, болезнь Крона и целиакия.
Менструальное кровотечение. При менструальном кровотечении происходит потеря эритроцитов.
Беременность. Если вы беременны и не принимаете пищевые добавки с фолиевой кислотой и железом, у вас повышенный риск развития анемии.
Хронические состояния. Рак, почечная недостаточность, диабет и другие хронические заболевания. Медленная хроническая кровопотеря из-за язвы или другого источника в вашем теле может истощить запасы железа в организме.
Наследственная предрасположенность.
Другие факторы. Перенесённые инфекционные заболевания, заболевания кроветворной системы и аутоиммунные заболевания, алкоголизм, воздействие токсичных химикатов и использование некоторых лекарств.
Возраст старше 65 лет
Признаки анемии варьируются в зависимости от причины ее возникновения. Симптомы могут маскироваться хроническими заболеваниями или просто быть похожими на обычную усталость.
Наиболее частые признаки и симптомы анемии:
Анемия
Не нашли ответ на свой вопрос?
Оставьте заявку и наши специалисты
проконсультируют Вас.
Общая информация
Анемия представляет собой нарушение состава крови, проявляющееся недостаточным содержанием гемоглобина. В большинстве случаев состояние обусловлено недостатком или патологией эритроцитов, содержащих гемоглобин. В норме гемоглобин эритроцитов крови присоединяет молекулы кислорода и обеспечивает клеточное дыхание, однако при анемии возникает недостаточное количество кислорода в организме. К характерным симптомам анемии врачи относят постоянную утомляемость, головокружение и бледность кожных покровов. Разные формы заболевания отличаются симптомами и осложнениями. Без лечения анемия может осложниться патологией сердечно-сосудистой системы, преждевременными родами и летальным исходом.
Анемия относится к самым распространенным заболеваниям крови: эта патология диагностируется у каждого десятого человека. Это может быть самостоятельная болезнь или осложнение другого патологического состояния. Недостаточное количество гемоглобина в крови чаще обнаруживается у беременных женщин и пожилых людей, поэтому людям из группы риска необходимо периодически проходить обследования. К основным методам лечения болезни врачи относят медикаментозную терапию и специальную диету.
Симптомы анемии
Разные формы анемии отличаются своими проявлениями. При этом выраженность симптомов зависит от степени дефицита гемоглобина в крови, возраста пациента и сопутствующих заболеваний. Недостаток кислорода в тканях в первую очередь влияет на состояние головного мозга, поскольку этому органу требуется много энергии для выполнения функций. В связи с этим многие пациенты жалуются на головокружение, ощущение «тумана в голове» и снижение работоспособности.
Другие симптомы и признаки:
- Постоянная усталость, слабость;
- Бледная или желтоватая кожа;
- Нерегулярное сердцебиение, неприятное ощущение в груди;
- Снижение концентрации внимания;
- Ухудшение памяти;
- Холодные руки и ноги;
- Шум в ушах;
- Головные боли;
- Нарушение дыхания (одышка);
- Снижение настроения, раздражительность.
Если у Вас наблюдаются подобные симптомы, советуем записаться на прием к врачу. Своевременная консультация предупредит негативные последствия для вашего здоровья. Телефон для записи +7 (495) 292-39-72
Причины анемии
Возникновение заболевания может быть обусловлено недостаточной выработкой гемоглобина, разрушением или постоянной потерей эритроцитов. Причиной состояния могут быть врожденные патологии крови и приобретенные заболевания, косвенно влияющие на содержание эритроцитов. В большинстве случаев анемия связана с состоянием желудочно-кишечного тракта. К факторам риска болезни врачи относят неправильную диету, беременность, неблагоприятную наследственность и пожилой возраст.
- Нехватка железа в организме из-за кровоизлияний, повышенного расходования железа и неправильного питания. Железо необходимо костному мозгу для постоянной выработки гемоглобина. Часто дефицит железа возникает на фоне желудочно-кишечных кровотечений, беременности, воспаления желудка и маточных кровотечений;
- Недостаток витамина B12. Это вещество необходимо организму для образования достаточного количества эритроцитов. Дефицит B12 может быть связан с неправильной диетой, гастритом, приемом некоторых лекарств и патологиями кишечника;
- Хронические заболевания внутренних органов, при которых нарушается выработка эритроцитов. В первую очередь это рак, ВИЧ-инфекция, аутоиммунные состояния, заболевания почек и болезнь Крона;
- Заболевания красного костного мозга, ответственного за выработку эритроцитов. Так, анемия развивается на фоне лейкоза, миелофиброза и других опасных состояний;
- Быстрое разрушение эритроцитов, не компенсируемое достаточным образованием клеток. Это гемолитическая анемия, возникающая на фоне инфекций, аутоиммунных заболеваний и отравлений;
- Наследственная патология крови, при которой у человека образуются эритроциты неправильной формы (серповидноклеточная анемия).
Определение причины анемии важно для подбора правильного лечения.
Диагностика анемии в «СМ-Клиника»
При появлении симптомов анемии необходимо записаться на прием к гематологу. Врач нашей клиники проводит опрос для определения симптомов и изучает анамнестические данные. Проводимый общий осмотр позволяет обнаружить неспецифические признаки заболевания, вроде бледности кожных покровов, одышки и нарушения ритма сердцебиения. Для уточнения формы и причины анемии гематолог назначает инструментальные и лабораторные исследования.
Назначаемые методы диагностики в «СМ-Клиника»:
- Общий и биохимический анализ крови. Для этого гематолог назначает взятие крови из вены. В процедурном кабинете специалист обрабатывает кожу локтевой ямки пациента антисептиком, пережимает сосуды жгутом и проводит взятие крови иглой. Полученный материал исследуется в лаборатории. Специалисты оценивают уровень гемоглобина, витамина В12 и других веществ в крови. Затем проводится подсчет количества и соотношения форменных элементов. Гематолога интересует количество и форма эритроцитов, содержание лейкоцитов и тромбоцитов. Содержание железа в плазме также является важным показателем;
- Пункция костного мозга. Гематолог подробно объясняет пациенту способ проведения процедуры и правила подготовки. С помощью анализов исключаются противопоказания к исследованию. Примерно за 30 минут до взятия материала врач дает пациенту успокоительное средство. Также проводится обезболивание тканей. В ходе процедуры врач производит прокол грудины иглой в заранее обозначенной области и с помощью шприца вытягивает материал. В лаборатории нашей клиники специалисты изучают ткани с помощью микроскопии и других методов для определения признаков заболеваний костного мозга. Биопсия костного мозга является важным исследованием при подозрении на тяжелую форму анемии;
- Эндоскопическое исследование желудочно-кишечного тракта при подозрении на кровоизлияние. Исследование верхних отделов проводится с помощью введения гибкой трубки в пищевод пациента через ротовое отверстие. Для осмотра слизистой оболочки кишечника врач назначает ирригоскопию или колоноскопию, при которых также проводится введение эндоскопа в полость органа. Проведение этих процедур под наркозом позволяет избавить пациента от неприятных ощущений;
- Анализ стула и мочи. Эти лабораторные исследования необходимы для исключения заболеваний почек и печени. При избыточном разрушении эритроцитов специалисты обнаруживают высокое содержание стеркобилина в стуле;
- Все исследования проводятся быстро и надежно, поскольку «СМ-Клиника» оснащена собственной лабораторией со всем необходимым оборудованием. Для более точной диагностики анемии гематолог назначает консультацию нефролога, гастроэнтеролога, эндокринолога или другого специалиста.
Терапевтическое лечение анемии в «СМ-Клиника»
Терапия разных форм анемии различна, однако к главным задачам лечения врачи относят восстановление нормального уровня гемоглобина в крови, устранение первопричины патологии и предотвращение развития осложнений. Немаловажным способом восстановления состава крови является лечебная диета, поэтому гематолог нашей клиники обязательно назначает пациенту специальный рацион исходя из диагностических данных. Лечением первопричины заболевания занимаются гастроэнтерологи, онкологи, гинекологи, хирурги и другие специалисты нашей клиники.
Проводимое лечение анемии в «СМ-Клиника»:
- Заместительная терапия препаратами железа. Гематолог назначает эти медикаменты для стимуляции образования гемоглобина в организме пациента. Препараты железа назначаются курсом на несколько недель или месяцев под контролем лабораторных исследований крови;
- Переливание крови или ее компонентов при тяжелой анемии и кровоизлиянии. Это мера неотложного лечения, проводимого только в стационаре под надзором врача. Пациенту внутривенно вводят необходимые компоненты после определения группы крови и резус-фактора. После устранения угрозы нарушения жизненно важных функций, пациенту назначают плановую терапию анемии;
- Лечение аутоиммунной анемии, при которой защитные системы организма уничтожают эритроциты. Гематолог назначает пациенту глюкокортикоидные гормоны и иммунодепрессанты. При необходимости применяется хлорохин;
- Внутривенное введение лекарств при разрушении эритроцитов на фоне токсического поражения организма. В стационаре гематолог назначает пациенту растворы дезинтоксикантов, витаминов и минеральных веществ. Также проводится введение диуретиков, антикоагулянтов и антиагрегантов. При тяжелом нарушении функций почек проводится гемодиализ;
- Пересадка компонентов костного мозга. Перед этим гематолог с помощью анализов определяет особенности клеток пациента для поиска совместимых доноров. Когда врачам удается найти донора, проводится специальная подготовка к трансплантации материала, направленная на уничтожение собственного костного мозга или подавление активности иммунитета. Процедура пересадки похожа на обычное переливание крови, в ходе которой пациент получает специально обработанный донорский материал.
Гематологи нашей клиники контролируют все этапы терапии с помощью анализов. Схема индивидуальной терапии подбирается в соответствии с современными стандартами лечения анемии.
Хирургическое лечение анемии в «СМ-Клиника»
Профилактика анемии
Соблюдение несложных правил позволит человеку уменьшить риск возникновения анемии.
Методы профилактики:
- Правильное питание. В рационе человека должны присутствовать продукты, богатые витаминами и железом;
- Обследования при возникновении факторов риска, вроде беременности или заболеваний желудка;
- Своевременное лечение хронических болезней почек, желудка, печени и других органов.
Гематологи «СМ-Клиника» объясняют методы профилактики анемии во время консультации.
АНЕМИЯ СЕРПОВИДНОКЛЕТОЧНАЯ
АНЕМИЯ СЕРПОВИДНОКЛЕТОЧНАЯ, наследственная болезнь человека, при которой красные кровяные клетки (эритроциты), отдавая свой кислород, принимают причудливую удлиненную форму, напоминающую полумесяц или серп. В норме эритроциты, отдавая кислород, меняют только цвет – ярко-красный на синеватый, но сохраняют свою обычную округлую форму. При данном заболевании клетки меняют не только цвет, но и форму. Непосредственная причина этого – небольшое изменение химической структуры гемоглобина, основного компонента эритроцитов. Однако это изменение (замена всего лишь одной аминокислоты в составе белковой части молекулы) приводит к тому, что образующийся у больных гемоглобин (гемоглобин S), отдавая присоединенный кислород, становится менее растворимым, чем нормальный гемоглобин (гемоглобин A), и превращается в плотный, полутвердый гель, что и вызывает деформацию эритроцитов. Синтез аномального гемоглобина в общем случае называют гемоглобинопатией.
Серповидноклеточная анемия наследуется, т.е. поражает определенные семьи, передаваясь через гены родителей детям. Таким образом, ею можно заболеть, только родившись с соответствующим генетическим нарушением. Если болен один из членов семьи, серповидные клетки должны иметься и у других ее членов, особенно у родителей и детей, часто у братьев и сестер, а нередко и у более далеких родственников.
Заболевание может протекать довольно легко или же очень тяжело. В первом случае симптомы возникают редко или только в особых условиях. Очень тяжелая форма обычно приводит к полной инвалидности, протекая с частыми приступами (кризами) и укорачивая жизнь больных. Существуют и промежуточные формы заболевания, при которых редко бывают столь тяжелые последствия и возможна бóльшая продолжительность жизни, но и они время от времени сопровождаются кризами.
Наследование.
Исследования показали, что легкая форма болезни обычно обнаруживается у гетерозигот по данному признаку – иными словами, у тех, кто унаследовал дефектный ген лишь от одного из родителей и передаст его только половине своих возможных потомков. У этих лиц имеется т.н. гетерозиготная серповидноклеточная анемия (S–A, или A–S). Хотя они сами практически не больны и могут никогда не заболеть, они все же носители болезни, причем – до проведения специального тестирования – скрытые носители.
Самой тяжелой формой заболевания страдают гомозиготы по дефектному гену, т.е. унаследовавшие его и от матери, и от отца; они передадут этот ген всем своим потомкам. Их состояние называют гомозиготной серповидноклеточной анемией (S–S).
Промежуточная форма заболевания встречается обычно у двойных гетерозигот, т.е. лиц, гетерозиготных как по данной, так и по какой-либо другой гемоглобинопатии (например, у них синтезируется гемоглобин C). В таких случаях говорят о болезни S–C или о каких-то сходных состояниях.
Распространенность.
Большинство пораженных семей принадлежит к черной расе, но болезнь встречается и среди белого населения. Она широко распространена в отдельных африканских странах, в частности в Гане, но в других регионах, например в Южной Африке, наблюдается крайне редко. Больные семьи обнаружены также в южных районах Индии, в Италии, Греции и Турции. В западном полушарии серповидноклеточной анемией страдают выходцы из Африки, Индии и средиземноморских стран, независимо от места своего проживания. Это заболевание встречается на всей территории США и Южной Америки, но чаще всего в районах компактного проживания афроамериканцев. По приблизительным данным, в США один из 10 афроамериканцев является носителем болезни, а у одного из 375 наблюдается явная ее форма; в целом же, число больных серповидноклеточной анемией в США, по оценкам, превышает 50 000.
Механизм заболевания.
У лиц с серповидноклеточной анемией большинство эритроцитов крови сохраняет обычную дисковидную форму. Однако в определенных обстоятельствах, а именно при недостатке кислорода, их форма изменяется. Они становятся удлиненными, остроконечными и жесткими, что препятствует их свободному перемещению по сосудистому руслу и приводит к закупорке кровеносных сосудов, особенно самых мелких. Из-за недостаточного кровоснабжения тканей в них начинаются процессы распада и воспаления, вызывающие боль и функциональные нарушения. Чаще всего боль возникает в конечностях, животе, пояснице или в голове. К наиболее часто поражаемым органам относятся легкие, кости, селезенка, почки, сердце и мозг.
Помимо причудливой формы, серповидные клетки характеризуются меньшей, чем у нормальных, прочностью и меньшей продолжительностью жизни. Поэтому у больных серповидноклеточной анемией, несмотря на повышенную скорость образования эритроцитов, содержание гемоглобина снижено. Они выглядят анемичными, а часто и несколько желтушными (из-за быстрого распада эритроцитов). В детстве и юности замедлены рост и созревание. Больные чрезвычайно восприимчивы к любой инфекции; хуже переносят нарушения питания и обезвоживание, поскольку почки теряют способность задерживать воду; хирургические операции и роды сопряжены с большей опасностью. Следует подчеркнуть, что осложнения и кризы возникают лишь время от времени. Даже у самых тяжелых больных бывают длительные периоды, когда они чувствуют себя относительно здоровыми и могут вести нормальный образ жизни.
Диагностические исследования.
В основе диагностики серповидноклеточной анемии лежит анализ физических свойств гемоглобина. Первым и самым старым методом такого анализа является исследование т.н. «влажного мазка». При смачивании мазка крови метабисульфитом натрия эритроциты отдают кислород и под микроскопом можно увидеть характерное изменение их формы. Для большей точности через 24 часа исследование повторяют. Другой, более распространенный метод основан на выявлении гемоглобина серповидных клеток по его сниженной растворимости в некоторых буферных растворах, что определяют по мутности раствора, содержащего такой гемоглобин. Широкое использование этого метода связано с возможностью быстрого получения результатов (уже через 10–15 минут).
К сожалению, указанные методы не позволяют отличить гетерозиготное состояние от гомозиготного. В настоящее время это можно сделать только с помощью электрофореза гемоглобина, т.е. анализа его подвижности в электрическом поле. Без такого анализа невозможны ни точная диагностика, ни надежное консультирование, но для массовых обследований он слишком дорог и занимает много времени.
Лечение.
На сегодняшний день серповидноклеточная анемия – неизлечимая болезнь. Однако ее выявление крайне важно для правильного лечения других заболеваний у данных больных, а также для оказания им адекватной хирургической и акушерской помощи. Правильное ведение больных с хронической серповидноклеточной анемией способствует предотвращению тяжелых обострений (кризов) и продлению жизни.
В ряде случаев развитие тяжелого криза удается предотвратить быстрым введением антибиотиков на ранних его стадиях (для купирования инфекции) и вливанием жидкости (гидратацией). Для лечения развившегося криза обычно используют кислород, обезболивающие средства, внутривенное введение жидкости и антибиотиков. Иногда приходится прибегать к переливанию эритроцитарной массы, а также применять многие другие средства, например противосудорожные препараты, для купирования отдельных симптомов. См. также АНЕМИЯ.