Активация иммунитета дендритные клетки и лимфоциты
Активация иммунитета дендритные клетки и лимфоциты
Патогенез ВИЧ-инфекции
Рецептором для ВИЧ является дифференцировочный антиген CD4, а также неспецифические, не зависящие от наличия CD4 компоненты. Фиксация вируса с мембранным рецептором CD4 клетки хозяина блокирует основную функцию этих иммунокомпетентных клеток — восприятие сигналов от антигенпрезентирующих клеток. Последующая за рецепцией репликация вируса ведет к гибели клеток, выпадению выполняемой ими функции и развитию иммунодефицита.
В организме человека имеется целый ряд иммунокомпетентных, соматических и ряд других клеток, имеющих рецепторы для ВИЧ (CD4+ лимфоциты, CD8+ лимфоциты, дендритные клетки, моноциты, эозинофилы, мегакариоциты, нейроны, микроглия, сперматозоиды).
Помимо основного рецептора для ВИЧ-1 — CD4, имеется еще ряд корецепторов, в частности, хемокиновые рецепторы, необходимые для проникновения ВИЧ в клетку.
Проникнув в CD4+ клетки, ВИЧ сразу же начинает репликацию. Все регуляторы, активирующие СD4+клетки, обеспечивают увеличение репликации вируса. К подобным регуляторам относятся фактор некроза опухолей (ФНО), фактор, стимулирующий колонии гранулоцитов/макрофагов, интерлейкин-6 (ИЛ-6). К негативным регуляторам, тормозящим репликацию вируса, относятся интерферон (ИФ) и трансформирующий фактор роста.
Выделено два типа СР4+клеток: Т-хелперы-1 (Th1) и Т-хелперы-2 (Th2). У больных ВИЧ-инфекцией идет угнетение Th1, чем обеспечиваются и вирусная патология, и онкогенез.
Жизненный цикл ВИЧ после проникновения в организм имеет последовательный характер: связывание вириона с поверхностью клетки, слияние мембран вириона иклетки, проникновение вируса внутрь клетки, высвобождение нуклеотида и геномной РНК вируса, интеграция генома вируса в геном инфицированной клетки, латентная фаза, фаза активации транскрипции с ДНК провируса и последующая транскрипция белков вируса, наработка всех компонентов вируса с формированием новых вирионов и их высвобождением из клетки, влекущим за собой гибель клетки-мишени.
В патологический процесс вовлекаются в первую очередь и в большей степени CD4+ лимфоциты, моноциты крови, макрофаги тканей, дендритные клетки крови, лимфатических узлов, селезенки, кожи, альвеолярных и интерстициальных макрофагов легких, микроглия и другие клетки нервной системы, имеющие CD4-рецепторы. Так же поражаются В- и О-лимфоциты, ретикулярные клетки, эпителиальные клетки кишечника, клетки Лангерганса, причем последние инфицируются даже легче, чем CD4+ лимфоциты. Именно клеткам Лангерганса придается большое значение в распространении ВИЧ по организму, ибо в них вирус сохраняется длительное время, иногда годы.
Наличие CD4 рецептора на многих и не только иммунокомпетентных клетках, возможность поражать и клетки, не имеющие этого рецептора, определяют политропность ВИЧ и полиморфизм клинической картины.
Если на CD4+ лимфоциты вирус оказывает цитопатическое действие с лизисом клетки или слиянием в синцитий, то в моноцитах/макрофагах ВИЧ реплицируется с умеренной интенсивностью и не оказывают цитонекротического действия. Изучение динамики сывороточных монокинов подтверждает активное участие в патогенезе ВИЧ-инфекции моноцитов/макрофагов, основных продуцентов фактора некроза опухолей и интерлейкина-1B. С гиперпродукцией ФНО-а, ИЛ-1b и ИЛ-6 связывают развитие при ВИЧ-инфекции лихорадки, анемии, диареи, кахексии, патологических изменений на коже и слизистых при саркоме Капоши, церебральных симптомов. В то же время было установлено, что ВИЧ ингибирует продукцию ИЛ-2 и g -ИФ, синтезируемым Т-хелперами первого типа, и не ингибирует функцию Т-хелперов второго типа. Следовательно, играя важную роль в регуляции синтеза цитокинов, ВИЧ за счет переключения иммунного ответа с Т-хелперов первого типа на Т-хелперы второго типа, стимулирует гуморальное звено иммунитета.
После инфицирования клетки вирусом происходит соединение вирусной оболочки с мембраной клетки. Помимо того, вирусный белок обеспечивает слияние мембран соседних клеток между собой с образованием одной многоядерной клетки — синцития. При этом слияние может быть как зараженных клеток между собой, так и зараженных с незараженными.
С момента интеграции генома вируса в геном клетки начинается стадия латентной инфекции. В этот период вирус находится в клетке в виде интегрированного в геном ДНК — провируса.
В расшифровке патогенеза ВИЧ-инфекции многие вопросы решены, установлены основные этапы развития процесса в клетке после инфицирования ее вирусом. Выявлен ряд факторов, активирующих экспрессию генов ВИЧ. К ним относятся факторы, активирующие Т-лимфоциты: специфические антигены (например, вирусы группы Herpes), неспецифические антигены (например, митогены типа фитогемаглютинина), цитокины (например, фактор некроза опухолей, некоторые интерлейкины, гамма-интерферон), бактериальные иммуномодуляторы. К активаторам экспрессии ВИЧ относятся глюкокортикостероидные гормоны, ультрафиолетовое облучение, перекись водорода, свободные кислородные радикалы. Активирует инфекционный процесс беременность.
Исключительно важный этап патогенеза болезни — сборка вирусных частиц и выход нового потомства вируса из инфицированной клетки. Отличительной чертой ВИЧ является взрывной характер процессов активации транскрипции, синтеза белков-предшественников, сборки вирионов и их почкования: за 5 минут одна лимфоцитарная клетка может образовать до 5000 вирусных частиц.
Вирусная экспрессия определяет клинику ранней фазы болезни. Пик экспрессии вируса в клетках лимфоидной ткани предшествует накоплению его в плазме. Появление вирусспецифических цитотоксических Т-лимфоцитов совпадает со временем окончания экспрессии вируса в лимфатических узлах. Образование нейтрализующих антител обеспечивает переход острой фазы болезни в хроническую.
Иммунопатогенетически ВИЧ-инфекция проявляется дефицитом Т- и В-звеньев иммунной системы, дефицитом комплемента, фагоцитов, снижением функции неспецифических факторов защиты. В результате идет формирование анергии с проявлениями аллергического, аутоаллергического и иммунокомплексного патологического процесса. Уже во II стадии ВИЧ-инфекция характеризуется снижением абсолютного числа лейкоцитов, повышением уровня естественных киллеров (NK-клетки), нарастанием реакции торможения миграции лимфоцитов. Изменения гуморального звена иммунитета проявляются нарастанием IgG+ В- лимфоцитов и 4-5-кратным ростом уровня сывороточных IgE. Выявляется диспропорция уровней подклассов иммуноглобулинов: IgG1 и IgG3 у больных увеличивается, а концентрация IgG2 и IgG4 существенно уменьшается. Несмотря на гипергаммаглобулинемию, увеличение количества циркулирующих в крови В-лимфоцитов, их функциональная активность на митогены остаются относительно сниженными, что позволяет В-систему иммунитета у ВИЧ-больных расценивать как супрессированную. Количество В-клеток в периферической крови больных в стадии СПИДа может быть снижено в три и более раз.
Взаимодействие ВИЧ-1 с мембраной CD4+ лимфоцитов определяет не только отрицательные реакции инфицированных клеток, но и приводит к программированной клеточной гибели — апоптозу зрелых CD4+ лимфоцитов или CD34+ гемопоэтических клеток-предшественников даже при отсутствии их инфицирования вирусом.
Л.Монтанье (1996) считает, что в патогенезе СПИДа основное место принадлежит аутоиммунному процессу. В пользу этого говорят исследования характера иммунных реакций у больных: наличие аутоантител и аллоантител к лимфоцитам, формирование аллергических реакций цитотоксического типа, накопление циркулирующих иммунных комплексов, наличие комплементопосредованной цитотоксичности, активация антителозависимой клеточной цитотоксичности. В пользу наличия аутоиммунных процессов в патогенезе ВИЧ-инфекции говорят и клинические проявления болезни, в частности, часто сопутствующие болезни такие типичные аутоаллергические варианты патологии, как спондилоартропатии, системные ревматоидные синдромы.
Формирование иммунодефицита при ВИЧ-инфекции не ограничивается только поражением лимфоцитов с CD4-фенотипом. Так, нарушение синтеза белков НLA I ведет к ингибированию функции лимфоцитов с CD8-фенотипа, т.е. Т-супрессоров. Белок вируса оказывает супрессивное действие на продукцию Т-клетками ИЛ-2 и g — интерферона. А с продукцией ИЛ-2 и других цитокинов тесно связана функция цитотоксических Т-лимфоцитов, ответственных за противовирусную и противоопухолевую защиту организма. Все это патогенетически определяет характерную для ВИЧ-инфекции ассоциированную вирусную, бактериальную, грибковую и онкопатологию.
Наряду с поражением иммунной системы в патологический процесс вовлекается и кроветворная ткань. Для заболевания характерны лейкопения, анемия, тромбоцитопения.
Таким образом, поражение иммунной системы при ВИЧ-инфекции носит системный характер, проявляясь глубокой супрессией Т- и В-звеньев клеточного иммунитета. В ходе развития ВИЧ-инфекции происходят закономерные изменения гиперчувствительности немедленного и замедленного типа, гуморального иммунитета и факторов неспецифической защиты, функциональной активности лимфоцитов и моноцитов/макрофагов. Нарастает уровень сывороточных иммуноглобулинов, циркулирующих иммунных комплексов. Наряду с дефицитом CD4+ лимфоцитов в динамике болезни нарастает функциональная недостаточность CD8+ лимфоцитов, NK-клеток, нейтрофилов. Нарушение иммунного статуса клинически проявляется инфекционным, аллергическим, аутоиммунным и лимфопролиферативным синдромами иммунологической недостаточности, синдромами, свойственными болезни иммунных комплексов. Все это определяет в целом клинику ВИЧ-инфекции.
Активация иммунитета дендритные клетки и лимфоциты
Презентация антигена,
кооперация иммунокомпетентных клеток
Презентация (представление антигена Т-лимфоцитам) осуществляется в результате поглощения антигена антигенпрезентирующей клеткой (АПК), расщепления его внутри клетки ферментами, связывания образующихся антигенных пептидов с молекулами МНС («загрузка» антигенных пептидов в желобки собственных молекул МНС I, II класса) и выхода их на поверхность клетки для представления (presentation) Т-лимфоцитам
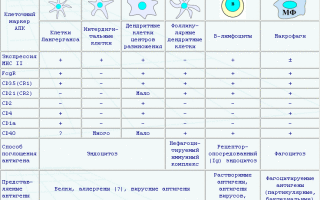
| Антигенраспознающие рецепторы В- и Т-лимфоцитов |
| Дендритные клетки (DC) |
Дендритные клетки (DC) — отростчатые, ветвистые клетки, основные представители антигенпрезентирующих клеток (АПК).
Дендритные клетки костномозгового происхождения находятся в слизистых оболочках и коже (клетки Лангерганса, или белые отростчатые эпидермоциты). Они более активны, чем макрофаги в индукции имуиного ответа. Захватив и переработав антиген, DC перемещаются в регионарные лимфоидные образования, тимусзависимые зоны, (в виде интердигитальных клеток) где с помощью молекул МНС презентируют антиген Т-лимфоцитам. В тимусе имеются интердигитальные медуллярные клетки, являющиеся антигенпрезентирующими клетками.
Дендритные клетки некостномозгового происхождения — фолликулярные дендритные клетки (FDC — Follicular Dendritic Cell) находятся в первичных и вторичных фолликулах лимфоузлов, селезенки и лимфоидной ткани слизистых оболочек. Они несут на поверхности иммунные комплексы антиген-антитело (без поглощения) и презентируют антиген В-лимфоцитам с помощью антительного Fc-рецептора (Fcγ R) и рецептора к комплементу (CRl, CR2), связанных с мембраной FDC. Фолликулярные дендритные клетки не имеют молекул МНС II.
Недавно во вторичных В-клеточных фолликулах лимфоидной ткани обнаружены дендритные клетки центров размножения . Они имеют молекулы МНС II, могут мигрировать и взаимодействовать с Т-лимфоцитами.
| Разновидности антигенпрезентирующих клеток |
 |
| Т-лимфоциты |
Т-лимфоциты (тимусзависимые лимфоциты) дифференцируются в тимусе — лимфоциты Тαβ . Другие — лимфоциты Тγδ возможно дифференцируются в слизистых оболочках ЖКТ. Имеют антигенраспознающий рецептор — TcR (T-клеточный рецептор), состоящий из двух форм — αβ или γδ. Антигенраспознающий рецептор — TcR распознает антигенный пептид, связанный с МНС антигенпрезентирующих клеток (АПК). В результате, при действии костимулирующих факторов, клетки дифференцируются в Т-хелперы или цитотоксические Т-лимфоциты. Важными корецепторными взаимодействиями между Т-лимфоцитом и антигенпрезентирующей клеткой являются CD28 — CDS80, CD154 (CD40L) — CD40.
NК-клетки (normal killers, или natural killers — нормальные киллеры) в кооперации с цитокинами оказывают неспецифическую цитотоксичность против инфицированных вирусом клеток, стареющих и опухолевых клеток. NK-клетки убивают клетки-мишени на основе лектинового распознавания или антителозависимои клеточной цитотоксичности (АЗКЦ). NK-клетки убивают клетки-мишени, которые (в какой-либо момент) не экспрессируют МНС I. Цитотоксическое действие NK-клеток сходно с действием цитотоксических лимфоцитов. При соединении NK-клетки с Fc-фрагментом антител, прикрепленных к клеткам с чужеродными антигенами, развивается антителозависимая клеточная цитотоксичность.
Различают две субпопуляции NК : CD56 много /CDl6 — и CD56 мало /CDl6 + . Субпопуляция NK с фенотипом CD56 мало /CDl6 + участвует в АЗКЦ. Вторая субпопуляция NK с фенотипом CD56 много /CDl6 — (так называемые Pit-клетки ) находится в синусоидах печени. Схожие клетки имеются в матке. Эти клетки убивают любые лимфоциты, которые активируются пищевыми антигенами и антигенами плода, обуславливая толерантность к этим антигенам.
| В-лимфоциты |
В-лимфоциты дифференцируются в костном мозге (или в бурсе — фабрициевой сумке, находящейся в клоаке птиц). Выполняют роль антигенпрезентирующей клетки (АПК) и, после преобразований (в результате связывания антигена) В-лимфоциты дифференцируются в плазматические клетки , продуцирующие антитела. В-лимфоциты получают антиген от фолликулярных дендритных клеток (FDC), несущих иммунные комплексы антиген-антитело, а также в результате рецептор-опоередованного поглощения.
 |  |
В-лимфоциты экспрессируют следующие молекулы: 1. Антигенраспознающий В-клеточный рецептор (BcR) представленный, гл. обр., мембранными иммуноглобулинами — мономерами mlg M, mlg D; 2. Корецепторный комплекс мембранных молекул [CD19/CR2 (CD21)/ТАРА-1], связанных с системами внутриклеточного проведения сигналов; 3. BcR-ассоциированные молекулы [Igα (CD79a) и Igβ (CD79b)], необходимые для сигнальной трансдукции; 4. Костимулирующие молекулы (CD28, CD40 и др.) для дополнительных стимулов и переключения синтеза разных изотипов антител; 5. Адгезивные молекулы (ICAM-3 и др.) для контакта клеток.
В иммунном ответе клетки взаимодействуют при межклеточном контакте мембранами и с помощью цитокинов. Различают следующие молекулы межклеточной адгезии : селектины, муциноподобные адрессины сосудов, интегрины и молекулы из суперсемейства иммуноглобулинов.
Селектины — молекулы (рецепторы) поверхности лимфоцитов, нейтрофилов, моноцитов, эозинофилов, взаимодействующие с лигандами (муциноподобными молекулами адрессинов CD34, GlyCAM-1 и MAdCAM-1) эндотелия сосудов. Участвуют в остановке клеток для их миграции через эндотелий.
Интегрины — молекулы поверхности Т-лимфоцитов, моноцитов, макрофагов, дендритных клеток, нейтрофилов, взаимодействующие с молекулами клеточной адгезии, фрагментами комплемента или с компонентами внеклеточного матрикса.
Нобелевская премия — 2011 по физиологии и медицине присуждена за изучение иммунитета
По традиции в начале октября в Стокгольме присуждаются Нобелевские премии. Как обычно, нобелевская неделя началась с присуждения премии по физиологии или медицине. Но в этом году Нобелевская ассамблея оплошала.

В Стокгольме началась так называемая нобелевская неделя: по давным-давно сложившейся традиции, это первая полная неделя октября. Та же самая традиция предусматривает и порядок присуждения Нобелевских премий. Первые три дня отданы естественным наукам: в понедельник объявляются имена лауреатов, удостоенных премии по физиологии или медицине, во вторник становятся известны имена лауреатов-физиков, в среду очередь доходит до химиков. В четверг общественности представляют лауреата премии по литературе, а завершается нобелевская неделя в пятницу присуждением премии мира — но уже не в Швеции, а в Норвегии.
Посмертный лауреат
В этом году Нобелевская ассамблея при Каролинском медицинском институте решила присудить самую престижную в научном мире премию по физиологии или медицине за 2011 год троим ученым. Но не поровну: одной половины премии удостоились совместно Брюс Бойтлер и Жюль Хоффман за их открытия, касающиеся активации врожденного иммунитета, а вторая половина досталась Ральфу Стейнману за открытие дендритных клеток и их роль в приобретенном иммунитете. Правда, спустя несколько часов после объявления выяснилось, что Ральф Стейнман не дожил до этого радостного события: он умер три дня назад, но в Каролинском институте ничего об этом не знали. Поскольку по статусу премии она не может присуждаться посмертно, Нобелевская ассамблея оказалась в сложном положении.
Две линии обороны
В пресс-релизе Нобелевской ассамблеи при Каролинском медицинском институте указывается, что лауреаты нынешнего года кардинально изменили наши представления об иммунной системе, выявив ключевые принципы ее активации. Ведь все мы живем в опасном мире: человек окружен вездесущими патогенными микроорганизмами — это и бактерии, и вирусы, и грибы, и паразиты, — и важнейшим механизмом защиты организма от этой угрозы является иммунная система. Задача первой линии обороны — врожденного иммунитета — состоит в том, чтобы уничтожить вторгшегося в организм агрессора и запустить воспалительный процесс, помогающий отразить нападение. Если же агрессор преодолеет первую линию обороны, в бой вступает вторая линия — приобретенный иммунитет. Он реализуется особыми клетками иммунной системы: Т-лимфоцитами и В-лимфоцитами. Т-лимфоциты распознают чужеродные антигены, а В-лимфоциты вырабатывают для их подавления соответствующие антитела. Приобретенный иммунитет тесно связан с так называемой иммунологической памятью: она формируется после столкновения организма с тем или иным инфекционным агентом и обеспечивает более быструю и эффективную ответную реакцию при каждом повторном появлении того же возбудителя.
От дрозофилы к мыши
На протяжении 20-го столетия ученым удалось шаг за шагом прояснить многие детали всех этих иммунных механизмов. Некоторые открытия удостоились и Нобелевской премии. Но до работ, выполненных нынешними лауреатами, было неясно, как активируется врожденный иммунитет и как он взаимодействует с приобретенным иммунитетом.
Самое первое из отмеченных сегодня открытий сделал Жюль Хоффман в 1996 году, изучая, как борется с инфекцией фруктовая муха дрозофила. Исследователь ставил эксперименты на мухах-мутантах и, в частности, обнаружил, что особи с мутацией гена, кодирующего особый белок — так называемый толл-рецептор, — не способны противиться инфекции. Толл-рецептор был незадолго до этого открыт немецкой исследовательницей Кристиане Нюсслайн-Фольхард, но она выявила его роль в эмбриональном развитии насекомого. Хоффман же показал, что этот белок выполняет важную функцию и в процессе идентификации и подавлении патогенных микроорганизмов.
Брюс Бойтлер искал рецептор, способный связывать липополисахариды — эти соединения, синтезируемые бактериями, могут вызывать крайне острую реакцию иммунной системы вплоть до септического шока. В 1998 году ученый обнаружил, что у мышей, резистентных к липополисахаридам, имеется мутация в гене, очень похожем на тот, что кодирует толл-рецептор у мухи-дрозофилы. Оказалось, что именно эти так называемые толл-подобные белки и являются рецепторами, реагирующими на липополисахариды. Связываясь с ними, эти толл-подобные рецепторы активируют иммунный ответ, проявляющийся в воспалении или — в особо тяжелых случаях — в септическом шоке. Так были открыты сенсоры активации врожденного иммунитета.
От клеточной культуры к человеку
Ральф Стейнман занимался изучением приобретенного иммунитета. В 1973 году он открыл так называемые дендритные клетки. Ученый высказал гипотезу, что эти клетки способны активировать Т-лимфоциты, играющие ключевую роль в формировании приобретенного иммунитета и иммунологической памяти. Свою гипотезу исследователь доказал в опытах на клеточный культурах. Поначалу результаты его работы были встречены с недоверием, но ученый не свернул с избранного пути и продемонстрировал скептикам, что именно дендритные клетки обладают уникальной способностью активировать Т-лимфоциты. Более того, в дальнейшем ученый показал, что дендритные клетки получают сигналы от врожденной иммунной системы и на их основе осуществляют регуляцию приобретенной иммунной системы, определяя интенсивность иммунного ответа.
Автор: Владимир Фрадкин
Редактор: Сергей Гуща
detector