Простатическая интраэпителиальная неоплазия PIN опухолей предстательной железы
Анализ результатов биопсий и ребиопсий предстательной железы в окружном урологическом отделении Западного административного округа г. Москвы за трехлетний период
- КЛЮЧЕВЫЕ СЛОВА: биопсия, ребиопсия, предстательная железа, заболевания предстательной железы, урология
Широкое распространение скринингового исследования мужчин для выявления рака предстательной железы путем определения уровня простатспецифического антигена (ПСА) привело к значительному увеличению числа трансректальных биопсий предстательной железы – метода, считающегося «золотым стандартом» диагностики рака простаты. Биопсия простаты, выполненная по надлежащим показаниям и с использованием оптимальной методики, предоставляет врачу необходимую информацию о наличии у пациента предракового поражения (простатическая интраэпителиальная неоплазия (ПИН) высокой степени) либо рака простаты.
Кроме того, по данным биопсии простаты врач может определить локализацию и протяженность опухоли в биоптате, наличие периневральной инвазии или инвазии капсулы предстательной железы, стадию дифференцировки опухолевых клеток (градация по шкале Глисона). Эти показатели в сочетании с другими клиническими данными позволяют установить стадию (T) и степень риска прогрессирования заболевания и/или рецидива после радикальной простатэктомии либо иного терапевтического вмешательства. Без этих сведений невозможно правильно выбрать метод лечения и определить стратегию дальнейшего ведения пациента, и потому интерпретация результатов биопсии простаты – одна из важнейших задач, которые стоят перед специалистом, практикующим в области урологии и онкоурологии.
Забор материала осуществляется в основном вдоль периферических отделов железы, в которых преимущественно выявляются ранние формы РПЖ. При трансректальной биопсии игла идет в косовертикальном направлении сзади кпереди [4], при этом в биоптат попадает большое количество ткани гиперплазированных переходных зон, объем забираемой ткани периферической зоны при ее атрофии существенно меньше. Несмотря на то что этот метод считается «золотым стандартом» диагностики РПЖ, количество повторных биопсий растет. По данным разных авторов, всего 17–33% биопсий оказываются положительными [5].
С чем связана низкая чувствительность «золотого стандарта» диагностики РПЖ? Во многих случаях при анализе патоморфологического исследования биоптата выявляются незлокачественные изменения железистого эпителия, ассоциированные с повышенным риском развития рака простаты у пациента и в связи с этим требующие проведения повторной биопсии. К таким настораживающим находкам относятся атипия c подозрением на аденокарциному или атипичная мелкоацинарная пролиферация (Atypical Small Acinar Proliferation, ASAP) и ПИН. Диагноз ПИН ставится в случае, когда в биоптате обнаруживаются железы, ацинусы и протоки которых выстланы атипичными клетками, однако присутствует интактный базальный слой, что отличает ПИН от аденокарциномы. Считается, что ПИН – это предраковое состояние, которое может иметь высокую или низкую степень неоплазии в зависимости от спектра и выраженности наблюдаемых неопластических изменений.
Исследования прошлых лет показали, что ПИН высокой степени ассоциирована с 27–65%-ным риском выявления рака простаты при ребиопсии [6], однако более современные работы, включившие данные расширенных биопсий, свидетельствуют о том, что риск все же не столь высок и составляет примерно 10–20%. В соответствии с рекомендациями Национальной всеобщей онкологической службы США (National Comprehensive Cancer Network, NCCN), в случае обнаружения ПИН высокой степени после стандартной секстантной биопсии (либо биопсии с количеством взятых проб менее 10) необходимо через 3 месяца провести повторную биопсию по расширенной методике (10 и более биоптатов). Если же с самого начала была проведена расширенная биопсия, больного следует подвергнуть повторной биопсии через 6–12 месяцев с использованием расширенной или сатурационной методики.
Термин «атипическая мелкоацинарная пролиферация» был впервые предложен K. Iczkowski для характеристики желез с признаками архитектурной и клеточной атипии, которые нельзя отнести к реактивной атипии, атипичной аденоматозной гиперплазии, ПИН или аденокарциноме простаты. ASAP не является предраковым состоянием, а выражает лишь неясность диагноза, то есть при ASAP нельзя с уверенностью сказать, соответствует ли наблюдаемая картина аденокарциноме или доброкачественному поражению. В связи с этим при получении диагноза ASAP рекомендуется консультация другого специалиста (желательно экспертного уровня) с пересмотром гистологических стекол, возможно использование иммуногистохимических методов анализа биоптатов.
Показано, что атипия с подозрением на рак ассоциирована примерно с 50%-ной вероятностью диагноза аденокарциномы при повторной биопсии, причем локализация аденокарциномы в большинстве случаев соответствует участку обнаруженной ранее атипии. По мнению P. Humphery, в 18–75% случаев под ASAP скрывается фокус аденокарциномы [7]. Именно поэтому в течение 3 месяцев после первой биопсии рекомендуется провести повторную биопсию по расширенной схеме, причем для повышения диагностической ценности ребиопсии NCCN рекомендует брать дополнительные пробы из участка атипии. Если при повторной биопсии рак не обнаружен, показано тщательное наблюдение с периодическим измерением уровня ПСА, проведением пальцевого ректального исследования и повторной биопсии (известно, впрочем, что проведения двух повторных биопсий после первоначальной достаточно для диагностики подавляющего большинства опухолей простаты).
Материалы и методы
Нами было проведено исследование с целью анализа результатов повторных биопсий предстательной железы, выполненных по поводу наличия ПИН высокой степени и ASAP в первичной биопсии. В исследование были включены 932 мужчины старше 50 лет, которые в 2009–2011 гг. были направлены в окружное урологическое отделение на базе городской поликлиники № 147 Западного округа Москвы для дообследования в связи с подозрением на рак простаты. Пациентам измерялся уровень ПСА, проводилось физикальное обследование, включая пальцевое ректальное и трансректальное ультразвуковое исследования простаты. Пациентам со значением ПСА больше 4 нг/мл выполнялась трансректальная мультифокальная биопсия простаты из 12 точек с последующим гистологическим исследованием, включая определение степени агрессивности рака простаты по шкале Глисона. Возраст больных варьировал от 50 до 79 лет, а средний возраст составил 62 года. По результатам гистологического исследования рак простаты был выявлен у 40% пациентов (n = 371). Средний уровень ПСА среди всех пациентов составил 14,6 нг/мл. У 65% (n = 607) пациентов с выявленным раком простаты значение ПСА находилось в так называемой «серой зоне» (4–10 нг/мл). Среднее значение ПСА «серой зоны» этой группы пациентов составило 6,7 (4,02–9,85) нг/мл. Был проведен анализ взаимосвязи уровня ПСА и индекса Глисона (табл. 1). Распределение пациентов по ПИН низкой и высокой степени и ASAP представлено в таблице 2.
При оценке гистологического материала выявлено, что порядка 23% (n = 214) биоптатов содержали ПИН высокой степени в сочетании с различной фоновой патологией (ДГПЖ, хронический простатит). РПЖ был верифицирован в 40% (n = 371) случаев. Сочетание ПИН + РПЖ обнаружено в 4,1% (n = 39) гистологических образцов. Если в возрастной группе 50–59 лет 13,3% (n = 124) биоптатов содержали ПИН, то в возрасте от 70 до 79 лет их доля составила 11,2% (n = 105). При проведении повторных биопсий у 16 пациентов с ПИН высокой степени через 3 месяца РПЖ выявлен в 6 (37,5%) наблюдениях, через 6 месяцев у 28 пациентов число верифицированных РПЖ составило 13 (46,4%), через 12 месяцев у 14 пациентов выявлено еще 4 (28,5%) случая РПЖ.
ASAP был выявлен у 89 пациентов (9,5%). Повторной биопсии через 3 месяца подверглись 68 пациентов. Остальным диагноз РПЖ был подтвержден в результате пересмотра гистологического материала с использованием иммуногистохимических методов анализа. Среди 68 пациентов с ASAP, подвергшихся повторной биопсии через 3 месяца, диагноз РПЖ был выставлен в 26 случаях (38,2%). Среди пациентов с наличием ASAP и ПИН высокой степени из 11 повторных биопсий РПЖ выявлен у 10 пациентов (90,1%).
Таким образом, в течение 1 года у 23 (39,6%) из 58 пациентов с ПИН высокой степени при повторной биопсии подтвердился диагноз РПЖ. Выявляемость РПЖ при наличии ASAP в нашем исследовании составила 38,2% и 90,1% при наличии ASAP и сочетания АSAP c ПИН высокой степени в биоптате соответственно. Наше исследование подтвердило, что ПИН высокой степени является предраковым состоянием. Результаты данного исследования свидетельствуют о том, что выявление ПИН высокой степени и ASAP является показанием для ребиопсий предстательной железы.
Авторами было проведено исследование с целью оценки частоты выявления рака предстательной железы при повторной биопсии простаты в окружном урологическом отделении Западного административного округа г. Москвы. Повторная биопсия назначалась при первично диагностированной простатической интраэпителиальной неоплазии высокой степени и атипичной мелкоацинарной пролиферации. Было подтверждено, что оба предраковых состояния являются показанием для проведения ребиопсии предстательной железы.
УЛЬТРАЗВУКОВАЯ ДИАГНОСТИКА РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ.
УЛЬТРАЗВУКОВАЯ ДИАГНОСТИКА РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ.
Для определения диагностической эффективности трансректального ультразвукового исследования (ТРУЗИ) в режимах серой шкалы, цветового (ЦДК) и энергетического доплеровского картирования (ЭДК) были проанализированы данные обследования 624 пациентов в возрасте от 49 до 85 лет. Из них 473 (75,8%) больных раком и 151 (24,2%) пациент с доброкачественными заболеваниями простаты. Всем пациентам было проведено трансректальное ультразвуковое исследование с мультифокальной биопсией.
Трансректальное ультразвуковое исследование в режимах серой шкалы, цветового и энергетического доплеровского картирования имело диагностическую точность 75,3%. При этом с возрастанием суммы Глисона повышается эффективность метода.
Трансректальное ультразвуковое исследование предстательной железы по даннымбольшинства авторов является высокочувствительным методом исследования, позволяющимвыявлять рак предстательной железы (РПЖ)(рак простаты) на ранних стадиях развития злокачественного процесса. При ультразвуко-вомисследовании наиболее характерным признаком рака простаты является гипоэхогенное образование в периферической зоне. Опухоль часто бывает многофокусная, поэтому выявляются множественные гипоэхогенные очаги. Ряд заболеваний простаты также приводит к выявлению гипоэхогенных участков: простатическая атрофия, острый очаговый простатит, туберкулез, простатическая интраэпителиальная неоплазия (ПИН) [1-4].
Ультразвуковая диагностика рака предстательной железы
1. Материалы и методы
Для определения диагностической эффективности трансректального ультразвукового исследования в режимах «серой шкалы», ЦДК и ЭДК были проанализированы данные обследования 624 пациентов в возрасте от 49 до 85 лет. Из них 473 (75,8%) больных ракоми 151 (24,2%) пациент с доброкачественными заболеваниями простаты (ДГПЖ). Всем пациентам было проведено трансректальное ультразвуковое исследование с прицельной и мультифокальной биопсией.
2. Полученные результаты и обсуждение
После гистологического исследования биоптатов предстательной железы больные раком простаты в зависимости от степени гистоморфологической опухоли по шкале Глисона и количества невыявленных новообразований распределились следующимобразом(табл. 1).
Распределение пациентов и ложно-отрицательных результатов ТРУЗИ в зависимости от показателя Глисона
Абсолютное число/количество ложноотрицательных результатов ТРУЗИ
Рак простаты с суммой Глисона до 5 только в 41,8% имел классическую эхографическую картину — единичный гипоэхогенный участок в периферической зоне и в 52,9% не имел характерных ультразвуковых признаков и не определялся ультразвуковымисследованием.
При показателе Глисона 5-7 в 62,6% выявлялся гипоэхогенный очаг в периферической зоне предстательной железы. У пациентов с суммой Гли-сона 5-7 не удалось диагностировать опухоль в 8,3%.
У пациентов суммой с Глисона 8-10 в 67,7% визуализировался гипоэхо-генный участок в периферической зоне, в 2,9% не определялся при ТРУЗИ.
Такимобразом, рак простаты с показателемГлисона до 5 наиболее труден для диагностики, который в 52,9% случаев не имеет ультразвуковых признаков. С увеличениемпоказателя Глисона возрастают количество и размеры гипоэхогенных очагов опухоли, что приводит к уменьшению пропущенных раков до 2,9% при сумме Глисона 8-10.
Использование для диагностики рака простаты трансректального ультразвукового исследования не позволяет выявлять 16,9% опухолей. Диагностические характеристики ультразвукового исследования приведены в табл. 2.
Диагностическая эффективность ТРУЗИ в выявлении РПЖ
«Серая шкала» + ЦДК+ЭДК
1. Предсказуемая ценность положительного теста
3.Предсказуемая ценность отрицательного теста
* -общий простатический специфический антиген (t-ПСА) = 4-10 нг/мл
Из вышеприведенной таблицы следует, что дополнение к сканированию в режиме «серой шкалы» цветового и энергетического доплеровского картирования не достаточно улучшает диагностические показатели. При увеличении чувствительности с 71,1 до 84,5% уменьшается специфичность данного метода с 54,8 до 47,7%, при этом диагностическая точность остается не достаточно высокой. Предсказательная ценность отрицательного результата 49,6% не позволяет использовать только ТРУЗИ для диагностики рака простаты без сочетания с другими диагностическими методиками, такими как определение различных формПСА и мультифокальная пункционная биопсия. Полученные нами данные согласуются с работами ряда исследователей [5, 6].
Точность диагностики ТРУЗИ в выявлении РПЖ зависит не только от степени гистоморфологической градации опухоли по шкале Глисона, но и от сопутствующих заболеваний предстательной железы. Особенно осложняет диагностику наличие у пациентов простатической интраэпителиальной неоплазии, которая нередко имитирует злокачественное новообразование. С другой стороны, наличие у пациентов доброкачественной гиперплазии часто маскирует злокачественное новообразование предстательной железы. Были проанализированы данные 151 пациента с доброкачественными изменениями предстательной железы для определения зависимости между нали-чиемсопутствующих заболеваний простаты и точностью ультразвукового исследования.
После гистологического анализа биоптатов предстательной железы пациенты с доброкачественными заболеваниями распределились следующим образом(табл. 3).
Как следует из приведенной ниже таблицы, у пациентов с доброкачественной гиперплазией в сочетании с хроническимпростатитомв 47,6% методом ТРУЗИ были получены ложно-положительные результаты. При сочетании ДГПЖ с ПИН низкой и высокой степени ложно-положительные заключения о наличии рака предстательной железы сделаны в 47,1 и 72,1% соответственно. Поэтому наиболее сложными для диагностики являются пациенты с доброкачественной гиперплазией в сочетании с простатической интраэпителиальной неоплазией высокой степени, у которых наиболее часто ошибочно определяются злокачественные новообразования.
Распределение пациентов с доброкачественными заболеваниями в зависимости от гистологического анализа
положительных заключений ТРУЗИ
ДГПЖ+ПИН низкой степени
ДГПЖ+ПИН высокой степени
Такимобразом, трансректальное ультразвуковое исследование, проведенное в режимах «серой шкалы», цветового и энергетического доплеров-ского картирования, у больных ракомпредстательной железы показало следующее. Эхографическая картина рака предстательной железы в режиме «серой шкалы» соответствует гистоморфологической градации опухоли по шкале Глисона. При сумме Глисона до 5 лишь в 41,8% рак простаты эхо-графически определялся как единичный гипоэхогенный очаг в периферической зоне предстательной железы размером не более 1 см. При показателе Глисона 5-6 в 60,9% наблюдений определялся гипоэхогенный очаг в периферической зоне предстательной железы. В 71% случаев визуализировался одиночный гипоэхогенный фокус размером 2-3 см. У большинства обследованных с суммой Глисона более 7 выявлялись множественные гипоэхоген-ные очаги или массивные гипоэхогенные зоны размерами более 3 см.
Степень васкуляризации рака простаты также отображает степень диф-ференцировки опухоли по шкале Глисона. В злокачественных новообразова-нияхссуммойГлисонадо5врежимахцветового и энергетического допле-ровского картирования в большинстве случаев выявлялся симметричный изоваскулярный кровоток. При показателе Глисона 5-6 в только в 16,7% определялся гиперваскулярный кровоток по сравнению с контралатераль-ным участком неизмененной паренхимы. Сосудистый рисунок визуализировался ассиметричный, неравномерный. В остальных 83,7% кровоток был не изменен в гипоэхогенных очагах. Опухоли с суммой Глисона более 7 в 83,3% имели повышенную сосудистую плотность. При этом гиперваскуляр-ный кровоток характеризовался хаотичнымтипомветвления сосудов.
Точность ультразвуковой диагностики рака простаты зависит не только от степени гистоморфологической градации по шкале Глисона, но и от сопутствующих заболеваний предстательной железы. У пациентов с суммой Глисона до 5 ультразвуковое исследование в 52,9% не определило наличие рака предстательной железы. При показателе Глисона 5-7 и больше 7 не удалось выявить опухоль в 8,3 и 2,9% соответственно. При сочетании доброкачественной гиперплазии с хроническимпростатитомв 47,6% были получены ложно-положительные результаты. При наличии доброкачественной гиперплазии и простатической интраэпителиальной неоплазии низкой и высокой степени выставлялись ложно-положительные заключения в 47,1 и 72,1% соответственно.
Обобщив и проанализировав полученные результаты, выяснилось, что добавление к серошкальному сканированию цветовых режимов повысило чувствительность на 13% (84,3%), при этомспецифичность снизилась на 7% (47,7%). ТРУЗИ в режимах «серой шкалы», цветового и энергетического допплеровского картирования имело чувствительность — 84,3%, диагностическую точность — 75,3%. При этом с возрастанием суммы Глисона повышалась эффективность обследования. Однако для диагностики ранних стадий заболевания, с низкимпоказателемГлисона, одиночное использование ТРУЗИ необоснованно. Основнымнедостаткомметода является низкая специфичность (47,7%) и предсказуемая ценность отрицательного результата (49,6%), что не позволяет использовать его изолированно для диагностики ранних стадий РПЖ. Поэтому необходимым условием раннего выявления РПЖ является включение в диагностический алгоритмдругих методов — определение различных формПСА и мультифокальной биопсии простаты.
[1] Амосов, А.В. Эхография и магнитно-резонансная томография в диагностике рака предстательной железы: тез. докл. 3-й Всероссийской научной конференции «Актуальные вопросы лечения онкоурологических заболеваний» / А.В.Амосов, С.В. Варшавский. М., 1999. С. 62-63.
[2] Игнашин, Н.С. Ультразвуковое исследование в диагностике новообразований мочевого пузыря и предстательной железы: дис. канд. мед.
наук / Н.С. Игнашин. М. 1983. 159 с.
[3] Шолохов, В.Н. Ультразвуковая диагностика рака предстательной железы: роль и место в диагностическом комплексе: тез. докл. 3-й Всероссийской научной конференции «Актуальные вопросы лечения онко-урологических заболеваний» / В.Н. Шолохов. М. 1999. С. 36-43.
Ультразвуковая диагностика рака предстательной железы
[4] Clements, R. Ultrasound of prostate cancer / R. Clements // Eur. Radiol.
2001. No. 11. P.2119-2125. [5] Predictors of prostate carcinoma: accurace of grey-scale and color Doppler
US and serum markers / E. Kuligowska [et al.] // Radiology. 2001. Sep;
Интраэпителиальная неоплазия предстательной железы высокой степени — High-grade prostatic intraepithelial neoplasia
| Интраэпителиальная неоплазия предстательной железы высокой степени | |
|---|---|
| Другие имена | Простатическая интраэпителиальная неоплазия |
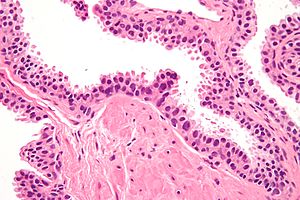 | |
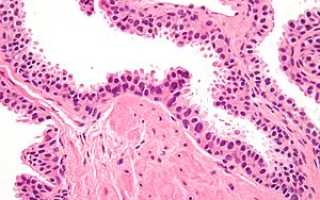
| Микрофотография, показывающая интраэпителиальную неоплазию предстательной железы высокой степени. Пятно H&E . | |
| Специальность | Урология |
Интраэпителиальная неоплазия предстательной железы высокой степени ( HGPIN ) — это аномалия предстательной железы, которая, как полагают, предшествует развитию аденокарциномы простаты (наиболее распространенной формы рака простаты ).
Это можно назвать просто интраэпителиальной неоплазией предстательной железы ( PIN ). Это считается предзлокачественным новообразованием или карциномой in situ предстательной железы .
Содержание
- 1 Признаки и симптомы
- 1.1 Связь с раком простаты
- 2 Гистология
- 3 Диагностика
- 4 Лечение
- 5 Прогноз
- 6 История
- 7 См. Также
- 8 ссылки
- 9 Внешние ссылки
Признаки и симптомы
Изолированный HGPIN протекает бессимптомно. Он обычно обнаруживается при биопсии простаты, взятой для исключения рака простаты, и очень часто обнаруживается при удалении простаты при раке простаты.
Отношение к раку простаты
Есть несколько причин, по которым PIN является наиболее вероятным предшественником рака простаты. PIN чаще встречается у мужчин с раком простаты. PIN высокого уровня можно найти в 85–100% образцов после радикальной простатэктомии , поблизости или даже в связи с раком простаты. Обычно это происходит в периферической зоне простаты. С возрастом он становится все более мультифокальным, как рак простаты. Молекулярный анализ показал, что ПИН высокой степени злокачественности и рак простаты имеют много общих генетических аномалий. Это было подтверждено на модели трансгенных мышей.
Риск для мужчин с высокой степенью PIN быть диагностированным с раком простаты после повторной биопсии снизился с момента введения биопсии более чем в шести местах (традиционные биопсии секстанта).
Гистология

HGPIN обычно имеет один из четырех различных гистологических паттернов:
Его цитологические признаки такие же, как у аденокарциномы простаты:
- наличие ядрышек ,
- повышенное ядерно-цитоплазматическое соотношение и,
- увеличенный размер ядра .
Микроскопически PIN представляет собой совокупность нерегулярных атипичных эпителиальных клеток . Архитектура желез и протоков остается нормальной. Эпителиальные клетки разрастаются, и скученность приводит к появлению псевдомногослойных клеток . Они остаются полностью внутри ацинуса предстательной железы (ягодообразное окончание железы, из которого вырабатывается секрет) или протока. Последнее можно продемонстрировать с помощью специальных методов окрашивания ( иммуногистохимия на цитокератины ) для идентификации базальных клеток, образующих поддерживающий слой ацинуса. При раке простаты аномальные клетки распространяются за пределы ацинуса и образуют кластеры без базальных клеток. В HGPIN базальный клеточный слой нарушен, но присутствует. PIN в основном обнаруживается в периферической зоне простаты (75-80%), редко в переходной зоне (10-15%) и очень редко в центральной зоне (5%), распределение, которое соответствует зональному распределению для простаты. карцинома.
Поскольку это считается предраковым состоянием, PIN часто считают эквивалентом простаты так называемой карциномы in situ (локализованный рак) в других органах. Однако PIN отличается от карциномы in situ тем, что он может оставаться неизменным или даже спонтанно регрессировать.
Было описано несколько архитектурных вариантов PIN, и во многих случаях есть несколько шаблонов. Основные из них — пучковые, микропапиллярные, ребристые и плоские. Хотя эти различия в внешнем виде могут вызывать путаницу с другими состояниями, они не имеют клинического значения. Более редкими типами являются клетки-печатки, нейроэндокринные клетки с мелкими клетками, муцинозные, пенистые, перевернутые и с плоскоклеточной дифференцировкой.
Диагностика
HGPIN диагностируется патологоанатомом из ткани , которая может исходить из:
- игла биопсия взята через прямую кишку и,
- хирургическое удаление ткани простаты:
- трансуретральная резекция простаты — удаление лишней ткани простаты для улучшения мочеиспускания (лечение доброкачественной гиперплазии простаты ),
- радикальная простатэктомия — полное удаление простаты и семенных пузырьков (лечение рака простаты).
лечение
Изолированный HGPIN не требует лечения. При биопсии простаты нельзя предсказать рак простаты через один год, если образец простаты был хорошо взят, то есть если было 8 или более ядер.
Точное время повторных биопсий остается предметом разногласий, так как время, необходимое для превращения HGPIN в рак простаты, и вероятность его возникновения не совсем понятны.
Прогноз
При последующей биопсии с учетом диагноза HGPIN в анамнезе вероятность обнаружения аденокарциномы предстательной железы составляет примерно 30%.
История
PIN исторически подразделялся на разные стадии в зависимости от уровня клеточной атипии. PIN раньше классифицировался как PIN 1, 2 или 3, в порядке возрастания нарушений в ячейках. В настоящее время PIN 1 называется PIN низкого уровня, а PIN 2 и PIN 3 сгруппированы вместе как PIN высокого уровня. Было показано, что только ПИН высокого уровня является фактором риска рака простаты. Поскольку PIN низкой степени не имеет значения и не требует повторных биопсий или лечения, он не упоминается в отчетах о патологии . Таким образом, ПИН-код стал синонимом ПИН-кода высокого уровня.
Ранняя диагностика рака предстательной железы – ключ к эффективному лечению
В марте 2015 г. в Цюрихе прошла конференция по классификации ВОЗ. Результат труда 110 специалистов из 20 стран — вышедшее в 2016 г. из печати 4-е издание книги «WHO Classification of Tumors of the Urinary System and Male Genital Organs».
Предстательная железа
ВОЗ выделила всего несколько новых гистологических групп, например простатическая интраэпителиальная неоплазия высокой степени (prostatic intraepithelial neoplasia (PIN) high grade) и внутрипротоковая карцинома NOS. Основное изменение — это замена шкалы Глисона на более современную.
«Главная из проблем шкалы Глисона в том, что баллы 2–5 в настоящее время уже не используются, — говорит проф. Holger Moch, представляя на конгрессе EAU изменения классификации. — Это особенно важно для пациентов, которые, «получив шестерку», логично, но неверно думают, что опухоль располагается в середине шкалы. Это усугубляет страх перед диагнозом, укрепляет веру в необходимость серьезного лечения».
Да и сама шкала в современном виде отличается от варианта, предложенного Дональдом Ф. Глисоном в 1966 г. Сейчас для опухоли с оценкой 6 по шкале Глисона прогноз лучше, чем для опухоли с такой же оценкой полвека назад.
Кроме того, разделение на три группы (6, 7 и 8–10) используется в терапевтических целях. Но «семерка семерке рознь», а прогнозы для опухолей с баллами 8 и 9-10 различны. Вдобавок в 2014 г. ISUP (International Society of Urological Pathology) снова пересмотрела шкалу: крибриформные и гломерулоидные структуры стали расцениваться как балл 4.
Новая система приводит к общему знаменателю все изменения; она стратифицирована в исследовании, объединившем более 26000 пациентов [1]. Теперь рак предстательной железы (РПЖ) может быть отнесен к одной из пяти групп, что позволяет более точно стратифицировать риск и снизить вероятность избыточного лечения.

В новейшей публикации 2016 г. M.A. Rubin et al. показал, что с увеличением порядкового номера группы увеличивается количество геномных альтераций. Если РПЖ, отнесенный к группе 1, остается гаплоидным, то в группах 2–5 увеличивается частота полиплоидии. По данным M.A. Rubin et al., группы 1–3 абсолютно разные с биологической точки зрения, в то время как 4–5 демонстрируют геномное сходство [2].
В будущем, полагают эксперты ВОЗ, новая классификация по РПЖ может полностью вытеснить шкалу Глисона. Сейчас во избежание путаницы рекомендуется одновременно использовать обе.
* По материалам статьи «Новый язык онкоурологов», газета «Урология сегодня» № 2 (41) 2016, URL:http://urotoday.ru/system/files/-2_2016_web_2.pdf
Правильное определение стадии рака предстательной железы и группы по шкале Глисона позволяет врачам назначить наиболее подходящий курс лечения для больного. Верно поставленный диагноз – это основной фактор, определяющий результат и эффективность лечения рака предстательной железы. Более того, ранняя диагностика рака простаты и внедрение в клиническую практику современных методов диагностики рака предстательной железы увеличивает вероятность выявления заболевания на ранних стадиях, когда еще возможно применение радикальных методов лечения.
Диагностика этого заболевания ставит две основные задачи: выявление заболевания и определение стадии и степени распространенности процесса, что имеет решающее значение для выбора лечебной тактики.
Одним из новых методов диагностики рака простаты является анализ PHI, который помогает избежать биопсии при подозрении на рак предстательной железы.
Индекс здоровья простаты (PHI) – на сегодня самый надежный способ выявления рака простаты до проведения биопсии, в случае, когда ПСА находится в пределах 2-10 нг/мл. При исследовании за одно взятие крови определяется PHI и еще три наиболее важных и актуальных параметра: [-2]проПСА, общий ПСА (ПСА, оПСА) и процент свободного ПСА (% свПСА)
ПСА И PHI – В ЧЕМ ОТЛИЧИЕ?
Определение простатического специфического антигена (ПСА) позволяет заподозрить наличие рака простаты. Но повышенный уровень ПСА – не всегда рак простаты, повышенные значения ПСА могут быть обусловлены инфекцией, травмой, доброкачественной гиперплазией предстательной железы и другими причинами. Поэтому поставить диагноз можно только по результатам биопсии – исследования ткани простаты. Забор материала проводится под анестезией, однако процедура дискомфортна и воспринимается мужчинами как стресс. Как показали многочисленные исследования, до 75% биопсий бесполезны. Достоверную картину о состоянии здоровья простаты представляет PHI, его рекомендовано проводить, когда ПСА выше нормы, но не более 10 нг/мл. Если показатель PHI низкий, то врач может отказаться от биопсии и продолжить наблюдение.
КАК ЧАСТО НЕОБХОДИМО СДАВАТЬ PHI?
Сдавать PHI необходимо только в том случает, если уровень ПСА выше нормы, но не более 10 нг/мл. Анализ ПСА рекомендуется сдавать всем мужчинам старше 45 лет каждый год. Важно помнить: чем раньше обнаружено заболевание и начнется лечение, тем быстрее наступит полное выздоровление.
Комплексное гистологическое и иммуногистохимическое исследование с определением опухоли предстательной железы (Ck5, P63, AMACR)
Комплексное исследование включает в себя два метода исследования (гистологическое и иммуногистохимическое), совместно использование которых позволяет повысить точность диагностики заболевания, определить оптимальные варианты лечения и скорректировать схему терапии.
- Гистологическое исследование с определением опухоли предстательной железы
- Иммуногистохимическая диагностика опухоли предстательной железы
Гистологическая и ИГХ диагностика опухоли простаты.
Complex histological and immunohistochemical examination with prostate tumor detection (Ck5, P63, AMACR).
Какой биоматериал можно использовать для исследования?
Образец ткани (биоптат) опухолевого образования предстательной железы.
Общая информация об исследовании
Рак предстательной железы (РПЖ) обусловлен развитием аномальных клеток в простате, которые могут неконтролируемым образом делиться и распространяться вне органа, поражая близлежащие или отдаленные части тела. Это, как правило, медленно развивающееся заболевание, которое в большинстве случаев в течение многих лет протекает бессимптомно, поэтому часто обнаруживается уже на продвинутых стадиях. В настоящее время летальность от этой патологии составляет 4,7%.
Может вызывать такие симптомы, как необходимость часто мочиться, особенно ночью, сложность начала или сдерживания мочеиспускания, слабый или прерывистый поток струи мочи, болезненное мочеиспускание, эректильная дисфункция, уменьшение количества эякулята, болезненная эякуляция, кровь в моче или сперме, давление или боль в прямой кишке, боль или скованность в нижней части спины, промежности или таза. Практически все указанные симптомы могут встречаться при других урологических заболеваниях (например, при простатите, доброкачественной простатической гипертрофии), которые очень распространены. При обнаружении в ходе ректального пальцевого обследования или по данным УЗИ опухолевидного образования и/или в случае обнаружения в крови повышенного содержания ПСА (простатспецифического антигена) высок риск онкологического заболевания простаты. Чтобы его исключить, может выполняться биопсия предстательной железы, полученный материал отправляется на гистологическое исследование. Оно позволяет выявить предраковые заболевания, подтвердить или исключить злокачественность процесса, верифицировать его, определить стадию, сопутствующие фоновые изменения и оценить агрессивность процесса.
Злокачественные новообразования предстательной железы морфологически классифицируются на эпителиальные (аденокарцинома, переходно-клеточный и плоскоклеточный рак) и неэпителиальные опухоли. В 95-97% случаев РПЖ представлен аденокарциномой, которая по своему строению микроскопически неоднородна. Но иногда (например, из-за недостаточного количества биоптата, вероятного отсутствия достаточного количества измененных желез для получения однозначного заключения, атипической мелкоацинарной пролиферации (ASAP)) возникают сложности с трактовкой результатов гистологического исследования — в таких случаях рекомендуется использовать иммуногистохимическое исследование (ИГХ) с антителами, направленными против базальных клеток (p63), к цитокератинам (Ck5) и с альфа-метилацил-кофермент А-рацемазой (α-melhylacylcoenzymeAracemase – AMACR). Оно позволяет не только достоверно верифицировать раковый процесс, но и обнаружить рак in situ.
Альфа-метилацил-КоАрацемаза участвует в бета-окислении жирных кислот и метаболизме желчных кислот и может быть обнаружена в нормальных тканях (например, гепатоцитах печени, в тубулярном эпителии почек, эпителии бронхов, желчном пузыре). Начиная с 2000 г., после установления связи между повышенной экспрессией AMACR и наличием карциномы простаты, этот белок стал рассматриваться как онкомаркер. Повышение экспрессии альфа-метилацил-КоАрацемазы возможно и при карциномах других локализаций (например, колоректальных, овариальных, груди, мочевого пузыря, легких, почечно-клеточных), тем не менее данный маркер высокоэффективен, так как позволяет провести дифференциальную диагностику рака с другими заболеваниями и более точно определить стадию процесса. AMACR позитивен как в случае наличия предракового поражения (простатической интраэпителиальной неоплазии (ПИН), так и при карциномах простаты, в том числе при ASAP. Считается, что чем выше экспрессия альфа-метилацил-КоАрацемазы, тем агрессивнее ведет себя опухоль.
Дополнительными маркерами базальных клеток для диагностики аденокарциномы являются p63, цитокератины (Ck) 5/6, цистатин А54 и кальциклин. При помощи маркера p63 можно обнаружить белок p63 в ядрах базальных клеток. Ген, кодирующий выработку этого белка, относится к семейству p53 опухолевых супрессорных генов. р63 обладает широким спектром биологических функций, включая участие в делении и дифференцировке клеток, его можно обнаружить в различных видах эпителия. Определение р63 помогает провести дифференцировку между доброкачественными и онкологическими процессами. Высокомолекулярные цитокератины также относятся к маркерам базального эпителия предстательной железы и, как правило, меньше экспрессируются или отсутствуют при раке предстательной железы.
Использование во время проведения исследования сразу нескольких маркеров повышает его чувствительность.
Для чего используется исследование?
- Для дифференциальной диагностики патологического процесса.
- Для определения вида и подвида опухоли, степени ее злокачественности и распространенности онкологического процесса.
- Для оценки фокусов атипических желез с подозрением на аденокарциному.
- Для подбора адекватной терапии, в том числе с учетом полученных результатов иммуногистохимического анализа.
- Для контроля эффективности лечения.
- Для верификации метастазов.
- Для динамического контроля и прогноза у лиц с предраковыми состояниями (ПИН).
Когда назначается исследование?
- При наличии симптомов и/или признаков, позволяющих заподозрить злокачественный процесс в предстательной железе (например, при обнаружении уплотнения в простате при пальцевом ректальном обследовании, при наличии характерных изменений в предстательной железе по данным УЗИ, при повышенном уровне ПСА).
- При атипичном течении заболевания, если во время первичной биопсии не было данных об онкологическом процессе.
- В случае обнаружения при первичной биопсии простатической интраэпителиальной неоплазии высокой степени.
- Для верификации метастатических опухолей.
Что означают результаты?
Проводится морфологическая оценка опухоли согласно классификации ВОЗ, оценка экспрессии маркеров в атипичных клетках. Диапазон референсных значений экспрессии маркеров индивидуален и зависит от многих факторов.
Правильно интерпретировать результат исследования может только врач.
Рак простаты
РАК ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ – ЗАБОЛЕВАНИЕ, ПРИ КОТОРОМ ЗЛОКАЧЕСТВЕННЫЕ (РАКОВЫЕ) КЛЕТКИ ОБРАЗУЮТСЯ В ТКАНЯХ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ.
Простата – это железа в мужской репродуктивной системе, расположенная чуть ниже мочевого пузыря и перед прямой кишкой, она окружает уретру (трубку, через которую моча транспортируется из мочевого пузыря); размер простаты – приблизительно с грецкий орех. Предстательная железа производит жидкость, которая является компонентом спермы.
По экспертной оценке ВОЗ, в мире ежегодно возникает около 400 тыс. случаев этого заболевания. В Европе в структуре смертности мужчин от злокачественных новообразований РПЖ занимает второе место после рака легкого. В России – четвертое, после рака легкого, рака желудка и новообразований мочевыделительной системы. Истинная распространенность патологии значительно выше официально зарегистрированной. В течение жизни рак простаты диагностируется у 1 мужчины из 6.
Вероятность выздоровления выше, а смертность меньше, если рак выявлен на начальной стадии, поэтому так важна информированность общества о раке простаты и своевременная диагностика. Новые достижения в области медицины позволяют пациентам с раком простаты после лечения вернуться к полноценной, активной жизни.

Симптомы
На ранних стадиях рак предстательной железы может протекать бессимптомно. Врач может обнаружить признаки рака простаты во время регулярного теста на ПСА (простат-специфический антиген) и/или ПРИ (пальцевое ректальное исследование).
Анализ крови на ПСА – первый простат-специфический антиген (ПСА) теста крови. Благодаря тесту на ПСА часто удается обнаружить рак простаты на начальной стадии. Уровень ПСА может быть высоким не только среди мужчин, имеющих рак простаты, но также у мужчин с увеличенной щитовидной железой и инфекциями предстательной железы. Тем не менее, только тест ПСА не всегда выявит, есть ли рак.
Когда появляются симптомы, они могут включать в себя:
- частое мочеиспускание (особенно в ночное время);
- затрудненное мочеиспускание;
- проблема начала или сдерживания мочеиспускания;
- слабый или прерывистый поток мочи;
- болезненность или жжение при мочеиспускании;
- кровь в моче или сперме;
- болезненная эякуляция;
- частые боли в нижней части спины, бедер или верхней части бедер.
Причины и факторы риска
Причины рака простаты, как и других видов рака, до конца не изучены. Нет единого взгляда на то, что вызывает рак простаты. Однако, есть определенные факторы, которые связаны с повышенным риском развития рака простаты.
Возраст и генетика
Рак предстательной железы довольно редок у мужчин до 50 лет, после этого возраста вероятность развития заболевания увеличивается. К 80 годам более половины всех мужчин будут иметь некоторую раковую опухоль, которая, возможно, и не потребует лечения. Рак предстательной железы может быть унаследованным генетическим фактором. Если у Вашего отца или брата был рак простаты, то риск развития этого заболевания у Вас удваивается. Риск выше, если у нескольких Ваших родственников был рак простаты, особенно если родственники были молоды на момент постановки диагноза.
Диета и образ жизни
В развитии и скорости развития рака простаты определенную роль играют образ жизни, диета и воздействие токсинов окружающей среды. Диета с высоким содержанием красного мяса, кальция (молочные продукты) и плохого холестерина (ЛПНП) значительно повышает риск заболевания. Неправильная диета, ожирение и отсутствие физической нагрузки может привести к развитию рака простаты. У мужчин с индексом массы тела (ИМТ) 32,5 и выше на 30% больше шансов умереть от рака простаты, а у мужчин с ИМТ 35 – на 60% больше шансов иметь рецидив рака простаты в течение 3 лет. Помогают предотвратить рак простаты диеты, богатые сырыми продуктами и овощами, продукты, богатые омега-3 и 6 жирными кислотами, а также продукты с большим содержанием антиоксидантов. Кроме того, для профилактики рака простаты полезны добавки селена, витамина Д и витамина Е, т. к. они помогают снизить уровень ПСА и подавить рост опухоли.
Рост рака простаты
В более чем 99% случаев рак простаты развивается из железистых клеток. Железистые клетки вырабатывают семенную жидкость, которая секретируется простатой. Медицинский термин рака, который начинается в железистых клетках – аденокарцинома. Большинство заболеваний растет очень медленно. Патологоанатомические исследования показывают, что многие пожилые мужчины, которые умерли от других заболеваний, так же страдали раком простаты, но ни они, ни их врачи не знали об этом. Однако есть случаи, когда рак может расти и распространяться очень быстро. Даже сейчас, при современном уровне развития медицины, трудно сказать, какие виды рака могут представлять угрозу для жизни, а какие не потребуют лечения.

Изменения клеток предстательной железы
Некоторые врачи считают, что рак предстательной железы начинается с так называемого состояния «простатическая интраэпителиальная неоплазия» (ПИН). ПИН начинает появляться у мужчин в возрасте от 20 лет. К 50 годам ПИН есть почти у 50% мужчин. В этом состоянии возникают микроскопические изменения (размер, форма и т.д.) клеток предстательной железы. Эти изменения бывают низкой степени (клетки оказываются почти нормальными) или высокой степени (клетки выглядят аномально). Если при помощи биопсии простаты Вам был диагностирован ПИН высокой степени, есть вероятность от 30 до 50 % того, что рак находится в пределах простаты. Мужчины с диагностированным ПИН высокой степени внимательно наблюдаются и периодически делают биопсию простаты.
Методы лечения
Существуют следующие методы хирургического лечения рака простаты:
- открытая хирургия;
- лапароскопическая хирургия;
- робот-ассистированная da Vinci хирургия.