Факторы свёртывания крови и как происходит процесс свертывания крови
Фактор свертываемости крови 13, субъединица A1 (F13A1). Выявление мутации G103T(Val34Leu)
OMIM +134570
Локализация гена на хромосоме – 6p25.1
Ген F13A1 кодирует А-субъединицу свертывающего фактора XIII (F13A1, субъединица А1) – белка, ответственного за конечную стадию в каскаде свертывания крови.
Генетический маркер G103T
Участок гена F13A1, в котором происходит замена нуклеотида гуанина (G) на тимин (Т) в позиции 103, обозначается как генетический маркер G103T. Следовательно, изменяются и биохимические свойства фермента, в котором аминокислота валин замещается на лейцин в позиции 34 аминокислотной последовательности белка.
Возможные генотипы
- G/G
- G/T
- T/T
Встречаемость в популяции
Встречаемость аллеля T в европейской популяции составляет 23 %.
Ассоциация маркера с заболеваниями
Общая информация об исследовании
Система гемостаза представляет собой совокупность биохимических процессов, обеспечивающих жидкое состояние крови, поддержание ее нормальных реологических свойств (вязкости), предупреждение и остановку кровотечений. В нее входят факторы свертывающей, естественной противосвертывающей и фибринолитической систем крови. В норме процессы в ней уравновешены, что поддерживает жидкое состояние крови. Смещение этого равновесия вследствие внутренних или внешних факторов может повышать риск кровотечений и тромбообразования.
Особое внимание при оценке риска тромбоэмболии и инфаркта миокарда уделяется генам коагуляционных (свертывающих) факторов крови 7 и 13 (F7, F13), изменения в которых в большинстве случаев направлены на обеспечение защитного эффекта. Снижение активности данных факторов способствует уменьшению тромбообразования.
Ген F13А1 кодирует А-субъединицу (F13A1, субъединица А-1) фактора XIII – белка, участвующего в процессе свертывания крови. Фактор XIII (F13), состоящий из двух А-субъединиц, имеющих каталитическую активность, и двух В-субъединиц, представляет собой плазматический гликопротеин, циркулирующий в плазме крови в комплексе с белком фибриногеном. При активации системы свертывания крови F13 подвергается расщеплению ферментом тромбином (фактором свертывания крови II, F2) в точке между аминокислотами аргинином и глицином, расположенными в положениях 37 и 38 аминокислотной последовательности. Кофактором в данной реакции являются ионы кальция. Активированный белок F13a катализирует «сшивание» мономеров фибрина, образуя связи между аминокислотами в положениях гамма-глутамил-эпсилон-лизин, что ведет к формированию фибрина-полимера. Фибрин – основа сгустка крови, он стабилизирует тромб, завершая процесс свертывания крови.
Изменения в гене F13A1 в большинстве случаев снижают риск развития патологий, связанных с повышенным тромбообразованием. Участок, в котором происходит замена нуклеотида гуанина (G) на тимин (Т) в позиции 103, обозначается как генетический маркер G103T. Вследствие замены нуклеотида валин замещается на лейцин в позиции 34 аминокислотной последовательности (V34L). Данный участок располагается в непосредственной близости от сайта взаимодействия F13 с тромбином. В результате замены преобразуются биохимические свойства белка F13, а именно его способность «сшивать» фибриновые мономеры, вследствие чего фибриновые сгустки получаются более тонкими.
Ассоциация маркера с инфарктом миокарда (ИМ)
Выявлено, что аллель T гена F13A1 встречается с меньшей частотой в группе пациентов с инфарктом миокарда по сравнению с контрольной группой.
При анализе статей, посвященных эффекту полиморфизма по маркеру G103T, связанного с риском развития инфаркта миокарда, исследователи оценили частотность аллелей в двух группах: у пациентов, перенесших инфаркт миокарда (3663 человека), и у контрольной группы (5080 здоровых людей). На основании проведенного анализа был доказан защитный эффект присутствия в генотипе аллеля Т.
Ассоциация маркера с венозным тромбозом
Генотип G/T обнаруживается у 38,6 % пациентов с глубоким венозным тромбозом и у 41,2 % здоровых людей, а генотип Т/Т у больных тромбозом выявлен всего в 1,6 % случаев, по сравнению с 9,6 % здоровых людей.
Таким образом, было показано, что гомозиготы по аллелю Т (генотип Т/Т) реже заболевают венозным тромбозом и вероятность инфаркта миокарда у них ниже.
Выявив генотип по данному маркеру, можно оценить генетическую предрасположенность к инфаркту миокарда, тромбоэмболии и провести соответствующие профилактические мероприятия.
Нарушения свертывания крови
Гемостаз — комплекс реакций организма, направленных на предупреждение и остановку кровотечений и поддержание циркулирующей крови в жидком состоянии. Система гемостаза обеспечивает остановку кровотечения путем образования тромба. Нарушения гемостаза приводят либо к кровоточивости, либо к тромбозам.
В гемостазе принимают участие тромбоциты и эндотелий — внутренняя стенка сосудов (сосудисто-тромбоцитарный гемостаз) и свертывающая система крови (коагуляционный гемостаз). Сосудисто-тромбоцитарный гемостаз включается сразу после повреждения сосуда. В мелких кровеносных сосудах гемостаз осуществляется путем их первичного спазма, приклеивания (адгезии) тромбоцитов к поврежденной стенке кровеносного сосуда, закупоркой кровоточащих сосудов агрегатами тромбоцитов и последующим укреплением тромбоцитной пробки фибрином. Прикрепившись к коллагену, тромбоциты выделяют ряд веществ, запускающих агрегацию — процесс, во время которого множество пластинок слипаются друг с другом, образуя тромбоцитарную пробку. Одновременно с этим активированные тромбоциты запускают процесс свертывания. Если повреждение небольшое, то сосудисто-тромбоцитарный гемостаз останавливает кровотечение уже через несколько минут. При значительном повреждении необходимо участие коагуляционного гемостаза.
Коагуляционный гемостаз обеспечивается факторами свертывания — протеазами крови, способными активировать друг друга (свертывающая система крови). Впервые каскадный механизм свертывания крови представили Р. Макфарлан, Р. Биггс (1964). Процесс свертывания крови может начаться как с внешнего повреждения сосуда, так и с активации тканевых факторов — внутренний механизм. Основную роль в остановке кровотечения играет так называемый внешний (быстрый, тканевой) механизм, который запускается тканевым фактором свертывания. При повреждении эндотелия тканевой фактор приходит в соприкосновение с кровью, последовательно активирует все факторы свертывания. Внутренний механизм свертывания крови (медленный, т.н. кровяной) — это многоступенчатая «каскадная» ферментная реакция.
В регуляции механизмов свертывания крови также принимают участие и процессы торможения. Противосвертываюшая и фибринолитическая (простациклин, антитромбин, плазмин, гепарин) системы предотвращают тромбоз неповрежденных сосудов, ограничивают распространение тромба и способствуют его растворению после восстановления целостности сосуда. Нарушения фибринолиза проявляются тромботическими осложнениями или отсроченными кровотечениями вследствие раннего растворения тромба. Возрастная депрессия (подавление) фибринолиза начинается с 45-50 лет, она усиливается гипокинезией, свойственной пожилым лицам и старикам.
Баланс между свертывающей и противосвертываюшей системами поддерживается благодаря взаимодействию тромбоцитов, факторов свертывания и процесса фибринолиза. Тромбоциты, как и все другие клетки крови, возникают из стволовых кроветворных клеток путем последовательных дифференцировок, через стадии мегакариобласта и мегакариоцита. Тромбоциты живут 7-11 сут.
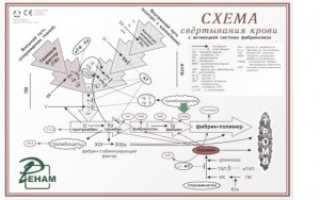
А. Свёртывание крови
При свёртывании крови происходит ферментативное превращение растворимого белка плазмы фибриногена (фактора I. см. Дыхание и брожение) в фибриновый полимер, сеть волокон нерастворимого белка. В этой реакции принимает участие фермент тромбин (фактор IIа), который протеолитически отщепляет от молекулы фибриногена небольшой пептидный фрагмент, в результате чего освобождаются участки связывания, что позволяет молекуле фибрина агрегировать в полимер. Затем с помощью глутамин-трансферазы (фактора XIII) образуются изопептидные связи боковых цепей аминокислот фибрина, что приводит к формированию нерастворимого фибринового сгустка (тромба).
Свёртывание крови может запускаться двумя различными путями: вследствие нарушения целостности ткани (внесосудистый путь, на схеме справа) или процессами, которые начинаются на внутренней поверхности сосуда (внутрисосудистый путь, на схеме слева). В обоих случаях запускается каскад протеолитических реакций: из неактивных предшественников ферментов (зимогенов, условно обозначаемых на схеме окружностями) путём отщепления пептидов образуются активные сериновые протеиназы (обозначаемые на схеме окрашенными кружочками с вырезанным сектором), которые в свою очередь действуют на другие белки. Оба реакционных пути нуждаются в ионах Ca 2+ и фосфолипидах [ФЛ (PL)] и оба завершаются активацией фактором Xa протромбина (фактора II) с образованием тромбина (IIа).
Внутрисосудистый путь инициируется коллагеном, который в норме не экспонирован на внутренней поверхности кровеносных сосудов: его контакт с кровью приводит к активации фактора XII. Внесосудистый путь активации начинается с освобождения фактора III (тканевого тромбопластина) из повреждённых клеток ткани. В течение нескольких секунд этот фактор приводит к свёртыванию крови в области раны.
Факторы свёртывания II, VII, IX и X содержат необычную аминокислоту, γ-карбоксиг-лутаминовую (Gla). Остатки Gla, которые образуются в результате посттрансляционного карбоксилирования остатков глутаминовой кислоты, группируются в особых белковых доменах. Они присоединяют ионы Ca 2+ и вследствие этого связывают соответствующие регуляторные факторы с фосфолипидами на поверхности плазматической мембраны. На рисунке это схематически представлено на примере протромбинового комплекса (Va, Xa и II). Вещества, способные связывать свободные ионы Ca 2+ в виде комплекса, например цитрат, предотвращают это взаимодействие с фосфолипидами и тормозят свёртывание. Для синтеза остатков Gla необходим в качестве кофактора витамин K (см. Медиаторы нервной системы). Антагонисты витамина К, такие, как дикумарин, подавляют синтез активных факторов коагуляции и действуют поэтому также как ингибиторы свёртывания.
Генетически обусловленный дефицит отдельных факторов свёртывания приводит к кровоточивости (гемофилия).
Контроль за свёртыванием крови (не показан на схеме). Процесс свёртывания крови находится в постоянном равновесии между активацией и торможением. Для торможения в плазме имеются очень эффективные ингибиторы протеиназ. Сериновые протеиназы системы свёртывания инактивируются антитромбином. Его действие усиливается сульфатированным глюкозаминогликаном — гепарином (см. Состав межклеточного матрикса). Тромбомодулин, расположенный на внутренней стенке кровеносных сосудов, инактивирует тромбин, образуя с ним стехиометрический комплекс. За протеолитическое разрушение факторов V и VIII в плазме отвечает белок c. Этот белок в свою очередь активируется тромбином и, тем самым, реализуется самотормозящийся механизм свёртывания крови.
Cochrane
Вопрос обзора
Способствуют ли лекарства, применяемые для профилактики и лечения кровотечений, снижению риска смерти, тромбообразования и уменьшению объема кровопотери у людей, не страдающих гемофилией (заболевание, сопровождающееся кровотечениями), при развитии кровотечения или наличии риска кровотечения?
Актуальность
Коагулопатия — это нарушение свертываемости крови, характерное для пациентов с тяжелыми заболеваниями, травмами и обширными операциями. Это состояние утяжеляет кровотечение и может привести к смерти. На сегодняшний день доступны лекарства, представляющие собой факторы свертывания крови, которые вводят внутривенно для лечения коагулопатии и остановки кровотечений. Однако, у нас недостаточно информации об эффективности и безопасности этих лекарств.
Этот обзор объединяет все доступные данные по этим лекарствам для оценки их эффективности и безопасности.
Характеристика исследований
Мы провели поиск медицинской литературы по состоянию на 18 апреля 2018 года. Целью поиска были рандомизированные контролируемые испытания (РКИ), поскольку они обеспечивают наиболее надежные доказательства. Всего было найдено 31 РКИ, включающие результаты, полученные на 2392 участниках. В испытаниях сравнивали изучаемые лекарства с плацебо (неактивное лечение), другими лекарствами или препаратами (продуктами) крови. Эти РКИ были сфокусированы на трех типах факторов, которые могут улучшать процессы свертывания крови: фибриноген (фактор свертывания, увеличивающий плотность кровяного сгустка), фактор свертывания XIII (важен для удержания сгустков крови вместе) и концентрат протромбинового комплекса (комбинация четырех предшественников факторов свертывания крови).
В этих испытаниях лекарства применяли либо до начала кровотечения (профилактически), либо для остановки уже начавшегося кровотечения (терапевтическое использование). Большинство испытаний были проведены в области хирургии, преимущественно в кардиохирургии, травматологии и при послеродовых кровотечениях.
Семнадцать РКИ были проведены при поддержке производителей лекарств, в восьми РКИ источники финансирования были не ясны, и в шести РКИ были указания на финансирование, не связанное с индустрией.
Основные результаты
Ни одно из лекарств не оказывало влияния на риск смерти пациента, независимо от клинической ситуации или способа применения лекарства. Однако, наша уверенность в результатах низкая. Возможно, эти результаты изменятся в будущем, когда будут опубликованы новые исследования.
Ни одно из лекарств не увеличивало риск опасного тромбообразования в в венах или артериях, но наша уверенность в этих результатах низкая.
Профилактическое применение фибриногена уменьшало кровотечение после кардиохирургических и ортопедических операций по сравнению с плацебо. Профилактическое применение фибриногена (при сравнении с плацебо) почти в два раза уменьшало необходимость в гемотрансфузии после операций на сердце и на три четверти — после других операций. Фибриноген снижал потребность в гемотрансфузии при применении для остановки кровотечения.
Профилактическое назначение фактора XIII уменьшало кровотечение после кардиохирургических вмешательств.
Для выявления каких-либо различий в общей выживаемости и смертности из-за кровотечений необходимо проведение РКИ со значительно большими размерами выборок.
Уверенность в доказательствах
Наша уверенность в полученных доказательствах низкая, но будущие исследования могут изменить результаты этого обзора.
Низкая уверенность в доказательствах не позволяет сделать выводы о том, насколько эффективны изученные лекарства и следует ли в настоящее время рекомендовать их применение в здравоохранении. Для оценки пользы и стоимости в соотношении с рисками изученных методов лечения требуется проведение дальнейших крупномасштабных РКИ.
Теории и модели свертывания крови
Теории и модели свертывания крови – от Шмидта до Монро
Основными функциями гемостаза являются поддержание жидкого состояния крови и быстрое купирование кровоточивости из места повреждения сосудистой стенки. В этом процессе принимают участие клетки крови, эндотелий сосудов и циркулирующие в крови белки – факторы свертывания крови и фибринолиза, активаторы и ингибиторы. Нарушение тонкого баланса взаимодействия всех этих компонентов, в том числе из-за врожденной недостаточности некоторых из них, приводит к развитию различных заболеваний (тромбоэмболических синдромов, диссеминированного внутрисосудистого свертывания, ишемии и инфарктов органов, гемофилии), нередко фатальных. Нарушение гемостаза происходит при таких видах патологии, как атеросклероз, иммунные и онкологические заболевания, акушерские осложнения и многие другие.
Создание первой научной теории свертывания крови в 1872 г. принадлежит русскому ученому Шмидту А.А., позже была дополнена, модифицирована и сформулирована как классическая ферментативная теория свертывания крови, которая в литературе получила название теории Шмидта-Моравица. До разработки современной клеточной теории свертывания крови для понимания механизмов гемостаза использовали «каскадную» модель свертывания крови (Davie E.W., Ratnoff O.D.; Macfarlane R.G., 1964 г.), где процесс свертывания крови подразделяется на первичный и вторичный гемостаз, с выделением «внешнего», «внутреннего» путей активации тромбина и «общего пути» (см. схему свертывания крови). Условным третьим этапом свертывания крови является процесс лизиса кровяного сгустка (фибринового тромба) — фибринолиз.
Итак, согласно классической каскадной модели свертывания крови, активация коагуляционных факторов, приводящая к образованию фибрина, осуществляется двумя путями: внешним (тканевым) и внутренним (тромбоцитарно-сосудистым), в зависимости от характера активирующей поверхности на начальных этапах процесса свертывания крови.

Для внешнего пути такой поверхностью является тканевой фактор (ТФ), который выделяется из поврежденного эндотелия и активирует фактор (ф.) VII при участии ионов кальция.
Внутренний путь рассматривается как процесс, который начинается с активации ф.XII при контакте крови с поврежденной сосудистой стенкой (субэндотелиальными компонентами сосудистой стенки, в частности с коллагеном), и проходит цепь последовательных реакций активации факторов XI, IX и VIII.
Оба пути приводят к активации ф.Х, и с этого момента процесс свертывания крови протекает по общему пути свертывания. Фактор Ха со своим кофактором Va образует протромбиназный ферментативный комплекс, который на поверхности тромбоцитов активирует протромбин с образованием тромбина. Образовавшийся тромбин поступает в ток крови и превращает фибриноген в фибрин-мономеры. Последние спонтанно соединяются, образуя полимеры фибрина.
Несмотря на то, что каскадная модель не совсем верно отражает суть функционирования системы гемостаза, ее до сих пор с успехом используют для интерпретации базовых (скрининговых) коагуляционных тестов, в которых искусственно воспроизведены условия активации ф.X по внешнему пути (протромбиновый тест) или внутреннему пути (активированное частичное тромбопластиновое время, АЧТВ).
Примечательно, что слово « каскад» не совсем верно отражал суть функционирования системы гемостаза, так как в процессе коагуляции имеется множество перекрёстных реакций, а «каскад» подразумевает лишь последовательную цепочку процессов. Цепочки реакций внутреннего, внешнего и общего путей гемостаза in vivo работают не изолированно, а в тесном взаимодействии друг с другом и с тромбоцитами. Как оказалось, взаимосвязь путей свертывания подтверждается способностью комплекса ТФ-ф.VIIa активировать фактор IX, а также способностью факторов XIIa и Ха активировать фактор VII.
Несмотря на сходную структуру мембранных липидов, клетки, несущие тканевой фактор, и активированные тромбоциты экспрессируют рецепторы, которые локализуют на их поверхности различные компоненты свертывающей системы крови.
Именно факт локализации различных коагуляционных факторов на поверхностях субэндотелиальных клеток и тромбоцитов позволил по-новому пересмотреть последовательность включения их в процесс формирования фибринового сгустка.
Классическая теория свертывания крови оставляла слишком много вопросов. Например, с одной стороны, было неясно, какая поверхность в физиологических условиях является активатором. С другой стороны, было не понятно, почему возможность образования протромбиназного комплекса (ф.Xa и ф.Va) по одному пути не компенсирует поломку в другом. А именно, почему активация фактора X внешним путем через комплекс ТФ-ф.VIIa не компенсирует недостаток факторов VIII или IX у больного гемофилией.
Аналогичный вопрос возникает и в отношении пациентов с дефицитом фактора VII, у которых при отсутствии нарушений во внутреннем пути развиваются тяжелые проявления кровоточивости. Если внутренний путь начинается с активации фактора XII, то почему его дефицит не вызывает тенденции к кровоточивости. Почему дефицит факторов внутреннего пути (ф.VIII, ф.IX, ф.XI) приводит к выраженной кровоточивости при нормальной активности факторов внешнего пути, а глубокий дефицит факторов внешнего пути не сопровождается геморрагическим синдромом. В современной теории гемостаза предпринята попытка разрешить данные противоречия.
Современная модель гемостаза – клеточная или клеточно-ассоциированная (Hoffman M, Monroe D., 2001 — Hoffman M., Monroe D.M. A cell-based model of hemostasis. Thromb Haemost. 2001; 85: 958-965). Согласно ей активацию, локализацию и концентрацию коагуляционных белков обеспечивают анионные фосфолипиды мембран, рецепторы и места связывания клеток (тромбоцитов, эндотелиоцитов, лейкоцитов). Клеточная модель свертывания описывает гемостатический процесс, происходящий по современным представлениям in vivo.
Клеточная модель свертывания не отрицает реакции взаимодействия и свойства факторов свёртывающей, противосвёртывающей и фибринолитической систем, представленных в каскадной модели свертывания. Она признает наличие внешнего и внутреннего пути свертывания, но существенно их модифицирует.
С учетом данных о локализации и контроле коагуляционных реакций на различных клеточных поверхностях, процесс свертывания крови в настоящее время представляют в виде трех перекрывающих друг друга фаз: инициации (initiation), усиления (amplification) и распространения (propagation).
1 фаза – инициация процесса свертывания крови, которая развивается за счет образования комплекса ТФ-ф.VIIa на поверхности субэндотелиальных клеток в месте повреждения сосудистой стенки и приводит к образованию незначительного стартового количества тромбина.
2 фаза – усиление процесса свертывания крови за счет активации тромбоцитов и целого ряда коагуляционных факторов тромбином, который образуется под влиянием комплекса ТФ-ф.VIIa.
3 фаза – распространение процесса свертывания крови с формированием теназного (ф.VIIIa/ф.IXa) и протромбиназного ф.Vа/ф.Xа/кальций/фактор III тромбоцитов) комплексов на поверхности активированных тромбоцитов. В результате образуется значительное количество тромбина («тромбиновый взрыв»), способного сформировать сгусток фибрина.
Инициация
Повреждение сосудистой стенки и/или внутрисосудистая активация клеток, экспрессирующих тканевой фактор, обеспечивает его контакт с ф.VII крови. Поскольку ТФ – интегральный мембранный белок, комплекс ТФ-ф.VIIa всегда связан с мембранной поверхностью клеток. Это важный момент, который объясняет локализацию коагуляционного каскада в зоне повреждения сосуда, то есть именно в том месте, где он необходим для остановки кровотечения.
Активный комплекс ТФ-ф.VIIa путем ограниченного протеолиза активирует факторы X и IX. При этом образовавшийся фактор IХа мигрирует с поверхности субэндотелиальных клеток, несущих ТФ, и связывается со специфическим рецептором на активированных тромбоцитах, которые находятся в непосредственной близости в зоне повреждения сосуда. Фактор Ха, оставаясь на поверхности субэндотелиальных клеток, вместе со своим кофактором – фактором Va расщепляет протромбин с образованием небольшого количества тромбина (ф.IIа).
Таким образом, в ходе инициации происходит активное взаимодействие эндотелия, тромбоцитов и факторов свёртывания крови. Повреждение (и/или дисфункция) эндотелия сосудов вызывает адгезию и агрегацию тромбоцитов и инициирует свёртывание крови. Активированные тромбоциты способствуют образованию тромбина. В свою очередь тромбин – мощный стимулятор агрегации тромбоцитов.
Усиление
Небольшое количество тромбина, образовавшегося в фазу инициации, активирует тромбоциты, факторы V, VIII и XI. Тромбин способствует высвобождению фактора VIII из комплекса с фактором Виллебранда, в результате образуется ф.VIIIa. Ф.XIa приобретает способность связываться с поверхностью тромбоцитов. Активированные небольшим количеством образовавшегося в фазу инициации тромбина факторы в следующую фазу (фазу распространения) обеспечивают формирование на тромбоцитарной матрице огромного количества тромбина, которое способно перевести фибриноген в фибрин. Таким образом, вышедший из фазы инициации тромбин выступает в качестве мощного усилителя коагуляции.
Распространение
В фазу распространения на поверхности активированных тромбоцитов происходит сборка, концентрация, активация факторов свёртывания и формируется теназный (ф.VIIIa/ф.IXa) комплекс. Теназный комплекс на поверхности тромбоцитов активирует ф.X, связанный со своим кофактором ф.Va, что ведет к образованию протромбиназного (ф.Va/ф.Xa) комплекса. Образовавшийся протромбиназный комплекс, в свою очередь, обеспечивает лавинообразное нарастание уровня тромбина. Тромбин вызывает гидролиз фибриногена до фибрина, а также активирует ф.ХIII, обеспечивающий стабилизацию фибриновых нитей и образование множества ковалентных перекрёстных связей между ними; такие прочные фибриновые волокна способны удерживать тромбоцитарную массу на месте повреждения. Затем происходит ретракция кровяного сгустка. Одновременно активируется фибринолитическая система.
Таким образом, по современным представлениям in vivo процесс свертывания крови является единым и связан с гемостатическими реакциями тромбоцитов. Благодаря их сложному рецепторному аппарату они не только участвуют в активации коагуляционных факторов, но и выполняют функцию регуляции всего процесса свертывания крови. Взаимосвязь тромбоцитов, факторов свертывания крови и сосудистой стенки постоянно уточняется.
Гемостаз крови
Определение гемостаза
Кровь выполняет несколько жизненно важных функций, в том числе — транспортную. Благодаря разветвленной системе кровообращения каждая клетка постоянно получает кислород, необходимые ей питательные вещества и отдает продукты обмена. Стоит лишить клетки головного мозга притока обогащенной кислородом крови на 30 секунд, и сознание может нарушиться. Чтобы все ткани и органы работали слаженно, кровь, насыщенная кислородом, должна постоянно, неуклонно двигаться по артериям на периферию и по венам — обратно, к сердцу.
Любые преграды на ее пути, например, атеросклеротические бляшки, тромбы или повреждения сосудов сопряжены с риском для здоровья или жизни. Предотвратить их образование, обеспечить беспрепятственное проникновение крови к каждой клетке помогает мудрая и сложная система — гемостаз.
Гемостаз с древнегреческого языка можно перевести как «остановка крови».
Кровь циркулирует в замкнутой системе под давлением. Система гемостаза поддерживает ее жидкое состояние, останавливает кровотечение, если сосуд поврежден, таким образом сохраняя баланс между свертывающей и противосвертывающей активностью.
Как работает гемостаз?
Гемостаз «включается в работу» автоматически, как только нарушается целостность кровеносного сосуда. При этом объем кровопотери значения не имеет — даже самая маленькая царапина «запускает» полную программу свертывания крови.
Свертывание протекает последовательно в три стадии 1 .
- Спазм сосуда
Повреждение сосудов, независимо от их размеров, — чрезвычайное происшествие, на которое первыми реагируют рецепторы боли, запускающие развитие рефлекторного сужения сосудов. Благодаря уменьшению их просвета снижается скорость кровотока и, соответственно, уменьшается кровопотеря.
Тромбоцитарный гемостаз
В работу по остановке кровотечения включается сама сосудистая стенка, которая в норме ведет себя по отношению к крови, которая перемещается по сосудам, абсолютно нейтрально, играя роль «проводника». Но как только сосуд оказывается поврежденным, он моментально становится активным участником событий. Одна из главных ролей в таком сценарии «спасения» достается коллагену, который содержится внутри сосудистой стенки. Даже при небольшой зоне повреждения волокна коллагена «обнажаются», к ним дружно направляются клетки крови — тромбоциты.
Коллаген и один из факторов свертывания крови «запускают» сложный биохимический процесс —активацию и агрегацию (то есть склеивание между собой) тромбоцитов с образованием тромбоцитарного или «белого» тромба, помогающего восстановить целостность сосуда.
Однако борьба с кровотечением на этом еще не заканчивается.
Коагуляционный гемостаз
После того как сгусток сформирован, происходит активация факторов свертывания крови — специальных белков, которые содержатся в плазме и тромбоцитах и обеспечивают свертывание. В результате из неактивного белка плазмы крови фибриногена образуется фибрин — белок в форме волокон. С его помощью вокруг сгустка тромбоцитов формируется фибриновая сеть, которая способна удерживать тромбоциты и другие клетки крови, включая эритроциты, формируя прочный красный тромб. Он качественно «латает» рану, стягивая ее края и окончательно восстанавливая целостность поврежденного сосуда.
На первый взгляд, на этом «ремонтные работы» закончены, но это не совсем так, ведь сформировавшийся тромб может нарушать кровоток за счет уменьшения просвета «отремонтированного» сосуда. Чтобы этого не происходило, когда задача тромба выполнена, – нужно, чтобы произошло его растворение — фибринолиз
Что такое фибринолиз?
Система фибринолиза, функционирующая в организме, предотвращает чрезмерное тромбообразование. Она же включается в работу, когда приходит пора растворить тромб, образовавшийся при повреждении сосудов. Ее еще называют антисвертывающей (фибринолитической) системой.
Когда в гемостазе происходят нарушения?
К сожалению, иногда в системе гемостаза появляются сбои, которые проявляются или патологической склонностью к кровотечениям, или, напротив, повышенным патологическим образованием тромбов — тромбозом.
Повышенная кровоточивость из-за имеющихся нарушений коагуляции может быть результатом ряда заболевания и состояний, среди которых 2 :
- Дефекты в самой сосудистой стенке
- Низкое количество тромбоцитов
- Недостаточность факторов свертывания
- Избыточный фибринолиз, который приводит к растворению «нужных» тромбов.
В обратной ситуации, когда нарушения связаны с избыточным образованием тромбов, проблема может быть обусловлена такими факторами 2 :
- Слишком высокое содержание веществ, активирующих тромбоциты
- Блокирование процесса фибринолиза (растворения тромбов)
- Застой крови и другие.
Виды нарушений гемостаза
Известно несколько состояний и заболеваний, которые способствуют нарушению разных звеньев гемостаза
Нарушение тромбоцитарного гемостаза 2
Тромбоцитопении — уменьшение количества тромбоцитов Снижение уровня тромбоцитов может быть следствием целого ряда заболеваний, в том числе:
- Апластические анемии
- Острый лейкоз
- Терапия цитостатиками (препаратами для лечения злокачественных опухолей), лучевая терапия
- Дефицит витамина В12, В9
- Тромбоцитопеническая пурпура.
Кроме того, снижение уровня тромбоцитов может быть вызвано сильным кровотечением.
Тромбоцитопатии — нарушение функции тромбоцитов, приводящие к повышенной кровоточивости. Могут быть обусловлены наследственными заболеваними, приемом лекарственных препаратов (например, приемом ацетилсалициловой кислоты) и другими факторами.
Нарушение коагуляционного гемостаза 2
К этому типу нарушений относятся коагулопатии — геморрагические диатезы, при которых кровь нормально не сворачивается. Они бывают наследственными и приобретенными.
К наследственным заболеваниям относится гемофилия, при которой отсутствуют или содержатся в недостаточном количестве некоторые факторы свертывания, вследствие чего кровь не сворачивается нормально.
У больных с приобретенными коагулопатиями может возникать дефицит сразу нескольких факторов свертывания крови. К нарушениям коагуляционного гемостаза относится гиперкоагуляция, при которой повышается способность крови к образованию тромбов.
К коагулопатиям также относится ДВС-синдром (диссеминированное внутрисосудистое свёртывание, синонимы: коагулопатия потребления, тромбогеморрагический синдром).
При ДВС-синдроме последовательно происходят два патологических процесса 2 :
- Нарушение свертывания крови, вследствие которого нарушается циркуляция в мелких сосудах
- Нарушение образования кровяных сгустков вследствие нарушений в системе гемостаза и, как результат, неконтролируемые кровотечения.
Яркое свидетельство ДВС-синдрома — образование в мелких сосудах тромбов.
Причинами развития ДВС-синдрома могут быть инфекции, сепсис, шок, ожоги, нарушение течения беременности, острый лейкоз, другие состояния и заболевания.
При подозрениях на нарушения гемостаза врачом могут быть назначены различные лабораторные исследования крови, позволяющие выявить указанные нарушения.