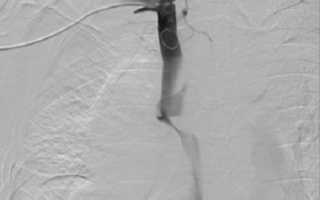
Что вызывает синдром сдавления верхней полой вены — определимся
Стентирование верхней полой вены
Пациент Х., 1938 года рождения (76 лет) поступил с жалобами на общую слабость, одышку при незначительной физической нагрузке. Считает себя больным с января 2014 года, когда отметил появление общей слабости, быстрой утомляемости. Постепенно присоединились одышка при незначительной физической нагрузке, сухой надсадный кашель. По месту жительства неоднократно проводилась антибактериальная терапия.
В июне 2014 года в связи с ухудшением состояния, присоединением болевого синдрома в области правой лопатки, правого плечевого сустава, выполнена компьютерная томография органов грудной клетки. По данным КТ органов грудной клетки: центральный рак правого легкого с распространением на средостение. Синдром верхней полой вены — стеноз ВПВ — контрастирование сохранено.
Направлен в Московскую городскую онкологическую больницу №62. Госпитализирован по срочным показаниям для попытки проведения химиотерапии. Учитывая нарастающую клиническую картину синдрома верхней полой вены, было принято решение о выполнении каваграфии с последующим стентированием верхней полой вены.
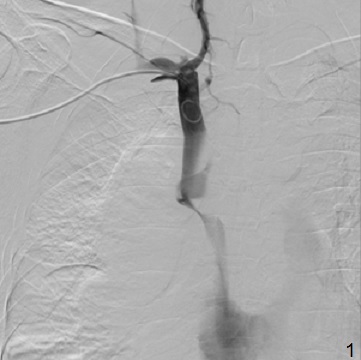
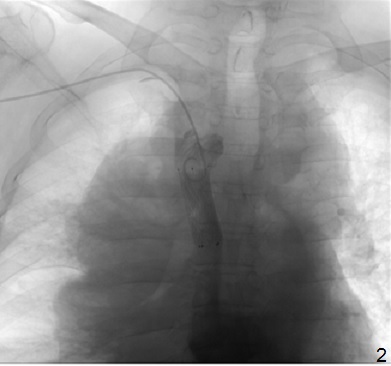
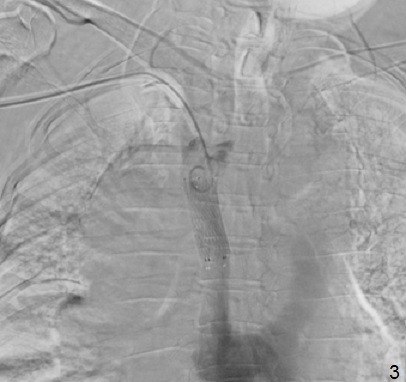
Выполнена каваграфия: визуализируется критический стеноз дистального сегмента верхней полой вены, венозный сброс осуществляется через расширенную непарную вену (1). В зону стеноза имплантирован саморасширяющийся стент Sinus — XL Stent 16mm*50mm (2). При контрольной каваграфии – ангиографический результат удовлетворительный, отмечается восстановление нормального кровотока по верхней полой вене, непарная вена не контрастируется (3).
Пациент Б., 1961 года рождения (54 года) поступил с жалобами на одышку при небольшой нагрузке, отечность лица, головные боли. Считает себя больным с декабря 2013 года, когда появилась температура 37.7, кашель с мокротой и сгустками крови, озноб, выраженная слабость. Обратился в поликлинику, где в ходе обследования была выявлена опухоль правого легкого. В последний месяц отметил нарастание одышки, отечность лица, усиление венозного рисунка на передней поверхности грудной клетки.
В срочном порядке госпитализирован в Московскую городскую онкологическую больницу №62, где в ходе обследования был заподозрен синдром верхней полой вены. Принято решение о выполнении каваграфии с возможным стентированием.
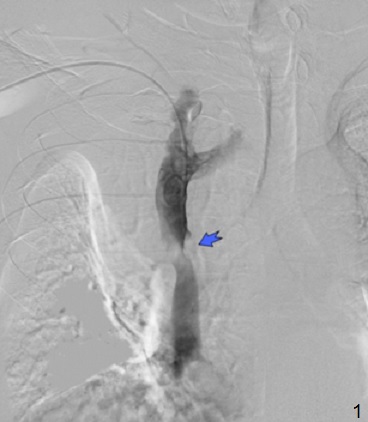
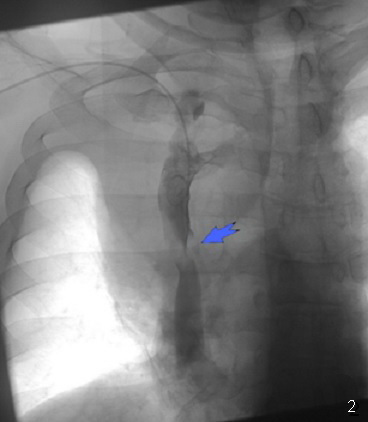
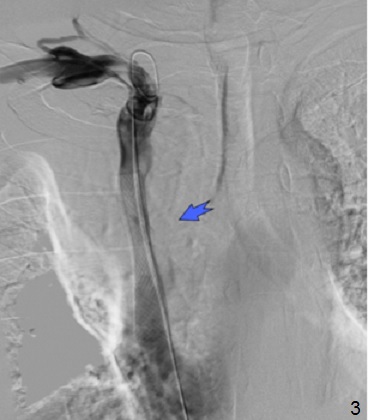
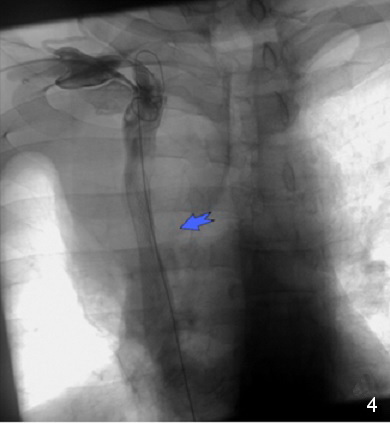
Каваграфия: отмечается стенозирование верхней полой вены в среднем сегменте более 90% (в месте стеноза отмечается наличие пристеночного образования, предположительно — опухолевый тромб), непарная вена не контрастируется (1, 2). Произведено стентирование места стеноза самораскрывающимся стентом BostonScientific 55*20mm (3, 4). На контрольной ангиограмме: ангиографический результат удовлетворительный, отмечается восстановление нормального кровотока по верхней полой вене, пристеночное образование прижато стентом и в просвете вены больше не визуализируется (3, 4).
Результаты резекции верхней полой вены у больных с опухолевыми заболеваниями легких и средостения
Полный текст:
- Аннотация
- Об авторах
- Список литературы
- Дополнительные файлы
- Cited By
Аннотация
Обоснование. Опухоли грудной клетки, вовлекающие стенку верхней полой вены (ВПВ), нередко встречаются в практике торакального хирурга, занимающегося лечением онкологических больных. Выполнение расширенных комбинированных операций, позволяющих удалить опухолевую ткань в полном объеме, улучшает общую и безрецидивную выживаемость больных и тем самым оправдано с онкологических позиций. У ряда больных в связи с длительно существующим синдромом ВПВ развитие венозных коллатералей создает повышенные риски тромбирования протеза в раннем послеоперационном периоде. В этом случае возможно выполнение циркулярной резекции ВПВ без ее последующего протезирования.
Цель – изучить непосредственные результаты резекции ВПВ у больных с опухолевой патологией грудной клетки, разработать алгоритм и выделить группу больных, у которых возможна циркулярная резекция ВПВ без протезирования.
Материал и методы. В исследование вошли 28 пациентов (22 мужчины, 6 женщин; средний возраст – 55 (от 21 до 70) лет), которым за 10-летний период (с 2008 по 2018 г.) была выполнена резекция ВПВ в ходе хирургического вмешательства по поводу злокачественной опухоли легкого или средостения в отделении торакальной хирургии МНИОИ им. П.А. Герцена. Были проанализированы непосредственные результаты операции, течение послеоперационного периода, технические особенности выполнения операции.
Результаты. Местнораспространенный рак легкого диагностирован у 19 (67%) больных, тимома – у 3 (10%), метастатическое поражение легкого – у 2 (7%), герминогенная опухоль средостения – у 2 (7%), рак тимуса – у 1 (3%), резидуальная лимфома (медиастинальная В-клеточная лимфома) – у 1 (3%) больного. У большинства больных – в 15 (53%) случаях – опухолевый процесс носил осложненный характер. У 4 больных с длительно существующим синдромом ВПВ выполнена циркулярная резекция ВПВ без протезирования. У 22 пациентов (78%) течение послеоперационного периода носило неосложненный характер. Послеоперационная летальность составила 7%.
Заключение. Резекция ВПВ может быть безопасно выполнена у пациентов с первичными опухолями средостения и легкого. При длительно существующем синдроме ВПВ развившиеся кава-кавальные анастомозы берут на себя ее значительную функцию, при этом циркулярная резекция ВПВ без протезирования при длительном синдроме сдавления относительно безопасна в случае компенсации коллатерального кровотока.
Ключевые слова
Об авторах
Александров Олег Александрович – мл. науч. сотр. отделения торакальной хирургии
125284, г. Москва, 2-й Боткинский пр-д, 3
Пикин Олег Валентинович – д-р мед. наук, заведующий отделением торакальной хирургии
125284, г. Москва, 2-й Боткинский пр-д, 3
Рябов Андрей Борисович – д-р мед. наук, руководитель отдела торакоабдоминальной онкохирургии
125284, г. Москва, 2-й Боткинский пр-д, 3
Список литературы
1. Danias PG, Pipilis AG. Superior vena cava syndrome: 1757-2007. Hellenic J Cardiol. 2007;48(6):366–7.
2. Spaggiari L, Leo F, Veronesi G, Solli P, Galetta D, Tatani B, Petrella F, Radice D. Superior vena cava resection for lung and mediastinal malignancies: a single-center experience with 70 cases. Ann Thorac Surg. 2007;83(1):223–9. doi: 10.1016/j.athoracsur.2006.07.075.
3. Wilson LD, Detterbeck FC, Yahalom J. Clinical practice. Superior vena cava syndrome with malignant causes. N Engl J Med. 2007;356(18): 1862–9. doi: 10.1056/NEJMcp067190.
4. Venuta F, Rendina EA. Superior vena cava resection and reconstruction. Eur J Cardiothorac Surg. 2012;41(5):1177–8. doi: 10.1093/ejcts/ezr266.
5. Jones DR. Technique of superior vena cava resection for lung carcinomas. Oper Tech Thorac Cardiovasc Surg. 2008;13(4):274–82. doi: 10.1053/j.optechstcvs.2009.01.002.
6. Cohen DJ, Ronnigen LD, Graeber GM, Deshong JL, Jaffin J, Burge JR, Zajtchuk R. Management of patients with malignant thymoma. J Thorac Cardiovasc Surg. 1984;87(2): 301–7.
7. Inaco Cirino LM, Ferreira Coelho R, Dias da Rocha I, Pinheiro de Senna Nogueira Batista B. Treatment of superior vena cava syndrome. J. Bras. Pneumol. 2005;31(6). doi: 10.1590/S180637132005000600013.
8. Lazzarino M, Orlandi E, Paulli M, Boveri E, Morra E, Brusamolino E, Kindl S, Rosso R, Astori C, Buonanno MC. Primary mediastinal B-cell lymphoma with sclerosis: an aggressive tumor with distinctive clinical and pathologic features. J Clin Oncol. 1993;11(12):2306–13. doi: 10.1200/JCO.1993.11.12.2306.
9. Perez-Soler R, McLaughlin P, Velasquez WS, Hagemeister FB, Zornoza J, Manning JT, Fuller LM, Cabanillas F. Clinical features and results of management of superior vena cava syndrome secondary to lymphoma. J Clin Oncol. 1984;2(4):260–6. doi: 10.1200/JCO.1984.2.4.260.
10. Holbert BL, Libshitz HI. Superior vena caval syndrome in primary mediastinal germ cell tumors. Can Assoc Radiol J. 1986;37(3):182–3.
11. Rowell NP, Gleeson FV. Steroids, radiotherapy, chemotherapy and stents for superior vena caval obstruction in carcinoma of the bronchus: a systematic review. Clin Oncol (R Coll Radiol). 2002;14(5):338–51. doi: 10.1053/clon.2002.0095.
12. Yagi K, Hirata T, Fukuse T, Yokomise H, Inui K, Ike O, Mizuno H, Aoki M, Hitomi S, Wada H. Surgical treatment for invasive thymoma, especially when the superior vena cava is invaded. Ann Thorac Surg. 1996;61(2):521–4. doi: 10.1016/0003-4975(95)00983-3.
13. Пикин ОВ, Трахтенберг АХ, Колбанов КИ, Глушко ВА, Казакевич ВИ, Амиралиев АМ, Вурсол ДА, Кирсанова ОН. Циркулярная резекция верхней полой вены без протезирования у больных с опухолью средостения, осложненной синдромом медиастинальной компрессии. Онкохирургия. 2013;5(2): 60–6.
14. Spaggiari L, Thomas P, Magdeleinat P, Kondo H, Rollet G, Regnard JF, Tsuchiya R, Pastorino U. Superior vena cava resection with prosthetic replacement for non-small cell lung cancer: long-term results of a multicentric study. Eur J Cardiothorac Surg. 2002;21(6): 1080–6. doi: 10.1016/s1010-7940(02)00175-6.
15. Александров ОА, Рябов АБ, Пикин ОВ. Тимома (обзор литературы). Сибирский онкологический журнал. 2017;16(4):76–83. doi: 10.21294/1814-4861-2017-16-4-76-83.
16. Fujisawa T, Yamaguchi Y, Baba M, Shiba M, Yamakawa H, Kimura H, Ogawa T, Kadoyama C, Yusa T, Iwai N. [Significance of superior vena cava reconstruction with EPTFE grafts in the surgical treatment of superior and anterior mediastinal invasive malignant tumors]. Nihon Kyobu Shikkan Gakkai Zasshi. 1990;28(4): 612–6. Japanese.
17. Scherck JP, Kerstein MD, Stansel HC Jr. The current status of vena caval replacement. Surgery. 1974;76(2):209–33.
18. Spaggiari L, Magdeleinat P, Kondo H, Thomas P, Leon ME, Rollet G, Regnard JF, Tsuchiya R, Pastorino U. Results of superior vena cava resection for lung cancer. Analysis of prognostic factors. Lung Cancer. 2004;44(3):339–46. doi: 10.1016/j.lungcan.2003.11.010.
19. Dartevelle PG, Chapelier AR, Pastorino U, Corbi P, Lenot B, Cerrina J, Bavoux EA, Verley JM, Neveux JY. Long-term follow-up after prosthetic replacement of the superior vena cava combined with resection of mediastinal-pulmonary malignant tumors. J Thorac Cardiovasc Surg. 1991;102(2):259–65.