Механизм развития и признаки легочного сердца методы лечения
Легочное сердце
, MD, Northwestern University Feinberg School of Medicine
- 3D модель (0)
- Аудио (0)
- Боковые панели (0)
- Видео (0)
- Изображения (1)
- Клинический калькулятор (0)
- Лабораторное исследование (0)
- Таблица (1)

Легочное сердце возникает вследствие патологии легких или их сосудов; сюда не относятся дилатация правого желудочка (ПЖ), вторичная к левожелудочковой (ЛЖ) недостаточности, врожденные пороки сердца (например, дефект межжелудочковой перегородки) или приобретенная патология клапанов. Легочное сердце обычно бывает хроническим состоянием, но может быть острым и обратимым. Первичная легочная гипертензия (т. е. не вызванная легочными или сердечными заболеваниями) рассматривается в другом разделе.
Патофизиология
Заболевания легких вызывают легочную артериальную гипертензию за счет нескольких механизмов:
Потери капиллярного русла (например, из-за буллезных изменений при ХОБЛ или легочной тромбоэмболии)
Вазоконстрикции, вызванной гипоксией, гиперкапнией или обоими состояниями
Увеличенного альвеолярного давления (например, при ХОБЛ, во время искусственной вентиляции легких)
Гипертрофии среднего слоя стенки артериол (частая реакция на легочную артериальную гипертензию, вызванную другими механизмами)
Легочная гипертензия увеличивает постнагрузку на ПЖ, приводя к тому же каскаду событий, которые возникают при левожелудочковой СН, включая увеличение конечного диастолического и центрального венозного давления, гипертрофию и дилатацию желудочка. Нагрузка на ПЖ может увеличиваться при повышении вязкости крови из-за вызванной гипоксией полицитемии. Иногда недостаточность ПЖ приводит к патологии ЛЖ, когда межжелудочковая перегородка, выбухающая в полость ЛЖ, препятствует наполнению ЛЖ, таким образом создавая его диастолическую дисфункцию.
Этиология
Острое легочное сердце имеет несколько причин. Хроническое легочное сердце обычно развивается при ХОБЛ, но существует еще ряд менее распространенных причин ( Причины легочного сердца). У пациентов с ХОБЛ при обострении или легочной инфекции может появиться перегрузка ПЖ. При хроническом легочном сердце риск венозной тромбоэмболии возрастает.
Причины легочного сердца
Массивная эмболия системы легочной артерии
Повреждение, связанное с искусственной вентиляцией легких (чаще у пациентов с ОРДС)
Обширная потеря ткани легкого из-за хирургического вмешательства или травмы
Хроническая легочная эмболия
Легочные вено-окклюзионные болезни
Интерстициальный легочный фиброз
Ожирение с альвеолярной гиповентиляцией
Нервномышечные нарушения, вовлекающие дыхательные мышцы
Идиопатическая альвеолярная гиповентиляция
*ХОБЛ — наиболее частая причина хронического cor pulmonale (легочного сердца).
ОРДС = острый респираторный дистресс-синдром.
Клинические проявления
Изначально «легочное сердце» протекает бессимптомно, хотя у пациентов обычно наблюдаются выраженные проявления основного заболевания легких (например, одышка, усталость при физической нагрузке) как результат первоначального заболевания легких. Позже, по мере нарастания давления в ПЖ, физикальные симптомы обычно включают систолическую пульсацию в области грудины слева, акцент второго тона на легочной артерии (S2) и шумы функциональной недостаточности трехстворчатого клапана и клапана легочной артерии. Позже присоединяются ритм галопа ПЖ (III (S3) и IV (S4) сердечные тоны), усиливающийся на вдохе, вздутие яремных вен (с доминантной a волной, в том случае, если присутствует трикуспидальная регургитация), гепатомегалия и отеки нижних конечностей.
Диагностика
Обследование с целью диагностики легочного сердца следует проводить у всех пациентов, имеющих хотя бы одну из причин его возможного развития. Рентгенограмма органов грудной клетки демонстрируют увеличение ПЖ и проксимальное расширение легочной артерии с дистальным ослаблением сосудистого рисунка. ЭКГ-признаки гипертрофии ПЖ (например, отклонение электрической оси вправо, зубец QR в отведении V1 и доминантный зубец R в отведениях V1 до V3) хорошо коррелируют со степенью легочной гипертензии. Однако, поскольку легочная гипервентиляция и буллы при ХОБЛ приводят к перестройке сердца, физикальное обследование, рентгенография и ЭКГ могут быть относительно нечувствительными.
Визуализация сердца при помощи эхокардиографии или радионуклидного сканирования необходима для оценки функций ЛЖ и ПЖ. Эхокардиография помогает оценить систолическое давление ПЖ, но при заболевании легких часто возможность ее выполнения технически ограничена; МРТ сердца может быть полезна для некоторых пациентов при оценке камер сердца и их функционирования. Для подтверждения диагноза может потребоваться катетеризация правых отделов сердца.
Лечение
Лечение причины заболевания
Заболевание тяжело поддается лечению; основное значение имеет устранение причины (см. в других разделах Р у к оводства ), особенно устранение или замедление прогрессирования гипоксии. Важны ранняя диагностика и лечение, т. к. в дальнейшем структурные изменения легких становятся необратимыми.
При наличии периферических отеков могут назначаться диуретики, однако они эффективны только при наличии недостаточности ЛЖ и перегрузке легких жидкостью. Диуретики могут нанести вред, поскольку небольшое снижение преднагрузки часто ухудшает cor pulmonale. Легочные вазодилататоры (например, гидралазин, блокаторы кальциевых каналов, оксид азота, простациклин, ингибиторы фосфодиэстеразы), эффективные при первичной легочной гипертензии, не дают результатов при легочном сердце. Бозентан (блокатор эндотелиновых рецепторов) может применяться у пациентов с первичной легочной гипертензией, при этом его использование недостаточно исследовано при легочном сердце. Дигоксин эффективен только при наличии сопутствующей дисфункции ЛЖ. Этот препарат следует назначать с осторожностью, поскольку пациенты с ХОБЛ очень чувствительны к его эффектам.
Высказывалось мнение, что при гипоксическом легочном сердце необходима флеботомия, но эффект уменьшения вязкости крови едва ли может снивелировать негативные последствия уменьшения объема крови, переносящей кислород, за исключением случаев значимой полицитемии. У пациентов с хроническим легочным сердцем длительный прием антикоагулянтов снижает риск венозной тромбоэмболии.
Ключевые моменты
Сor pulmonale (легочное сердце) – расширение ПЖ и впоследствии недостаточность, вторичная по отношению к заболеваниям легких, которые сопровождаются развитием гипертензии легочной артерии.
Cor pulmonale (легочное сердце), как таковое, обычно протекает бессимптомно, но общие физические показатели включают в себя левый парастернальный систолический подъем, громкий легочный компонент S2, функциональную недостаточность трехстворчатого клапана и шум над легочной артерией; позже — вздутие яремной вены, гепатомегалия, отеки нижних конечностей.
При диагностике обычно необходимо проведение эхокардиографии или радионуклидной визуализации, а в некоторых случаях — катетеризации правых отделов сердца.
Раннее выявление и лечение причин заболевания имеют важное значение до того, как структурные изменения сердца становятся необратимыми.
Хотя у пациентов могут наблюдаться существенные периферические отеки, прием диуретиков не показан и может нанести вред; небольшое снижение преднагрузки часто ухудшает cor pulmonale (легочное сердце).
Особенности состояния системы гемостаза на этапах развития и прогрессирования хронического легочного сердца
Полный текст:
- Аннотация
- Об авторе
- Список литературы
- Cited By
Аннотация
Цель. Изучить состояние системы гемостаза и реологии крови у больных хронической обструктивной болезнью легких (ХОБЛ) при развитии хронического легочного сердца (ХЛС) и прогрессировании сердечной недостаточности (СН). Материал и методы. Обследованы 54 больных ХОБЛ, средний возраст 56,3±8,2 года: 1 группа – 17 больных ХОБЛ без ХЛС, 2 группа – 17 больных c ХОБЛ и компенсированным ХЛС, 3 группа – 20 больных с ХОБЛ, ХЛС и ХСН. Группу контроля составили 16 здоровых лиц. Определяли показатели сосудисто-тромбоцитарного гемостаза: количество тромбоцитов, спонтанную агрегацию тромбоцитов, индуцированную агрегационную активность тромбоцитов и способность тромбоцитарных агрегатов к дезагрегации; плазменного гемостаза: коагуляционного, антикоагулянтного и фибринолитического звеньев; реологии крови: величину гематокрита, свободную седиментацию эритроцитов, агрегацию эритроцитов. Результаты. У больных ХОБЛ развивался хронический синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром) в стадии умеренной декомпенсации, приводящий к нарушениям микрогемоциркуляции. В формировании ХЛС установлена роль прогрессивно нарастающего микротромбогенеза в кровотоке больных ХОБЛ, способствующего усилению нарушений микроциркуляции в легких и прогрессированию легочной гипертензии. У больных с ХЛС и ХСН состояние системы гемостаза характеризовалось наличием ДВС-синдрома в стадии выраженной декомпенсации, на локальном органном уровне наблюдалось резкое снижение компенсаторных возможностей вторичного фибринолиза. Заключение. В исследовании продемонстрирована ведущая роль системы гемостаза в развитии ХЛС и прогрессировании ХСН у больных ХОБЛ. Дисбаланс между активностью микротромбообразования и вторичным органным фибринолизом можно рассматривать как маркер развития ХСН у больных ХОБЛ.
Ключевые слова
Об авторе
Список литературы
1. Балуда В.П., Балуда М.В., Гольдберг А.П. и др. Претромботическое состояние. Тромбоз и его профилактика. МоскваАмстердам «Зеркало-М» 1999; 297 с.
2. Воробьев П.А. Актуальный гемостаз. Москва «Ньюдиамед» 2004; 139 с.
3. Карпов Р.С., Дудко В.А., Кляшев С.М. Сердце-легкие: патогенез, клиника, функциональная диагностика и лечение сочетанных форм ишемической болезни сердца и хронических обструктивных болезней легких. Томск «STT» 2004; 605 с.
4. Панченко Е.П., Добровольский А.Б. Тромбозы в кардиологии. Механизмы развития и возможности терапии. Москва 1999; 462 с.
5. Соколов Е.И., Попкова А.М., Медведев С.Н. и др. Динамика показателей системы гемостаза у больных хроническим легочным сердцем при хроническом обструктивном бронхите. Кардиология 1996; 5: 59-62.
6. Федорова Т.А. Хроническое легочное сердце. Хронические обструктивные болезни легких. Под ред. А.Г. Чучалина. Москва ЗАО «Издательство БИНОМ» 1999; 192-215.
7. Яковлев В.А., Куренкова И.Г. Легочное сердце. СПб: Медицинское информационное агентство 1996; 351 с.
8. Consensus statement. Prevention of venous thromboembolism. International consensus statement. (Guidelines According to Scientific Evidence). Intern Angiol 1997; 16: 3-28.
9. Grippi M. Pulmonary pathophysiology. Philadelphia: Lippincott Co 1996; 330 p.
Для цитирования:
Чесникова А.И. Особенности состояния системы гемостаза на этапах развития и прогрессирования хронического легочного сердца. Кардиоваскулярная терапия и профилактика. 2006;5(2):50-56.
For citation:
Chesnikova A.I. Hemostasis at various stages of chronic pulmonary heart development. Cardiovascular Therapy and Prevention. 2006;5(2):50-56. (In Russ.)

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Сердечная недостаточность
Сердечный цикл
Сердечный цикл состоит из очень тонко и точно синхронизированных электрических и механических процессов, которые приводят к ритмичному сокращению предсердий и желудочков, благодаря чему кровь поступает в малый и большой круг кровообращения. Механическая систола отражает сокращение желудочков, а диастола — их расслабление и наполнение кровью. Во время сердечного цикла кровь из системных и легочных вен непрерывно поступает в сердце через правое и левое предсердия, соответственно. Во время диастолы кровь поступает из предсердий в желудочки через открытые трехстворчатый и митральный клапаны. Сокращение желудочков означает начало механической систолы, в результате которой кровь выбрасывается в сосуды малого и большого круга кровообращения.
Понятие сердечная недостаточность
В норме сердце при относительно низком давлении во время диастолы принимает в себя кровь и при более высоком давлении в систолу проталкивает кровь вперед. Сердечная недостаточность определяется как неспособность сердца перекачивать объем крови, необходимый для обеспечения метаболических потребностей организма («систолическая дисфункция») или возможность обеспечивать эти потребности только благодаря ненормально высокому давлению заполнения полостей сердца («диастолическая дисфункция»), или за счет обоих этих механизмов.
Причины сердечной недостаточности
Сердечная недостаточность может быть основным проявлением практически всех болезней сердца, включая атеросклероз коронарных сосудов, инфаркт миокарда, приобретенные пороки клапанов сердца, врожденные пороки сердца, аритмии и кардиомиопатии.
В зависимости от снижения функциональной способности того или иного желудочка сердца, различают:
- Левожелудочковую недостаточность;
- Правожелудочковую недостаточность;
- Бивентрикулярную недостаточность (снижена сократимость обоих желудочков сердца).
Все возможные этиологические факторы по механизму развития левожелудочковой сердечной недостаточности можно разделить на:
- снижающие сократительную способность сердечной мышцы (инфаркт миокарда, преходящая ишемия миокарда, недостаточность митрального или аортального клапанов сердца, дилатационная кардиомиопатия);
- повышающие постнагрузку (т.е. сопротивление, которое желудочек сердца должен преодолеть, выбрасывая кровь) — стеноз аортального клапана, артериальная гипертензия;
- нарушающие заполнение левого желудочка (стеноз митрального клапана, тампонада сердца, гипертрофическая кардиомиопатия, гипертрофия левого желудочка).
В свою очередь, левожелудочковая сердечная недостаточность — наиболее частая причина развития правожелудочковой недостаточности, которая в данном случае обусловлена увеличением постнагрузки из-за дисфункции левого желудочка и повышения сопротивления легочных сосудов.
Причинами развития правожелудочковой недостаточности наиболее часто являются
- заболевания сердца (врожденные пороки сердца, инфаркт правого желудочка, левожелудочковая недостаточность);
- заболевания легких (хронические обструктивные заболевания легких, интерстициальное поражение легких);
- заболевания сосудов легких (первичная легочная гипертензия).
Как и в случае с левожелудочковой недостаточностью, изолированная правожелудочковая недостаточность негативно влияет на функциональную способность левого желудочка, так как уменьшение выброса крови правым желудочком приводит к снижению наполнения левого желудочка и, как следствие, к уменьшению ударного объема и сердечного выброса.
К факторам, провоцирующим возникновение симптомов застоя у больных с компенсированной сердечной недостаточностью, относятся
Состояния, сопровождающиеся активацией метаболических процессов
- Лихорадка,
- Инфекция,
- Анемия,
- Тахикардия,
- Гипертиреоз,
- Беременность.
Увеличение объема циркулирующей крови
- Избыточное потребление поваренной соли,
- Избыточное потребление жидкости,
- Почечная недостаточность.
Состояния, сопровождающиеся повышением постнагрузки
- Эмболия легочной артерии,
- Нелеченная артериальная гипертензия,
- Состояния, сопровождающиеся нарушением сократимости миокарда,
- Ишемия или инфаркт миокарда,
- Чрезмерное употребление алкоголя,
- Несоблюдение режима медикаментозной терапии сердечной недостаточности,
- Выраженная брадикардия.
Признаки сердечной недостаточности
✔ Наиболее выраженным симптомом хронической левожелудочковой недостаточности является одышка при нагрузке, что связано с венозным застоем в легких или низким сердечным выбросом. По мере прогрессирования заболевания одышка может наблюдаться и в состоянии покоя.
✔ Часто сердечная недостаточность сопровождается ортопноэ, ночными приступами сердечной астмы и ночным кашлем. Ортопноэ — это затруднение дыхания в положении лежа и уменьшающееся в сидячем положении. Причиной данного симптома служит перераспределение крови из органов брюшной полости и нижних конечностей в легкие в положении лежа. В некоторых случаях, ортопноэ бывает настолько выражено, что больной вынужден спать в положении сидя.
✔ Ночные приступы сердечной астмы — это тяжелые приступы одышки во время ночного сна. Данный симптом наблюдается в положении лежа при проникновении в кровь жидкости из отеков нижних конечностей, что приводит к увеличению объема циркулирующей крови и венозного возврата в сердце и легкие.
✔ Ночной кашель — также является симптомом застоя крови в легких, его механизм развития идентичен механизму развития ортопноэ. В некоторых случаях может наблюдаться кровохаркание, что обусловлено разрывом вен бронхов из-за их полнокровия.
✔ К типичным проявлениям сердечной недостаточности относятся спутанность сознания и уменьшение дневного диуреза, вследствие уменьшения кровоснабжения головного мозга и почек, соответственно. Иногда может быть усилен ночной диурез, так как в положении лежа кровоснабжение почек улучшается. Также характерна общая слабость и быстрая утомляемость, ввиду недостаточного кровоснабжения скелетной мускулатуры.
✔ Больные с изолированной правожелудочковой недостаточностью, нередко испытывают чувство дискомфорта в правом подреберье, что обусловлено избыточным кровенаполнением печени и растяжением ее капсулы. В тяжелых случаях, возможно скопление жидкости в брюшной полости (асцит). Также характерным признаком является развитие периферических отеков, особенно на лодыжках. Если больной длительное время находился в вертикальном положении, то такие отеки усиливаются к концу дня, исчезая при этом утром.
На практике для оценки тяжести сердечной недостаточности часто используют классификацию Нью-Йоркской Ассоциации кардиологов (NYHA):
I класс — Физическая активность не ограничена
II класс — Легкое ограничение активности. Появление одышки и слабости после умеренной физической нагрузки
III класс — Выраженное ограничение активности. Одышка после минимальной физической нагрузки
IV класс — Тяжелое ограничение активности. Симптомы сердечной недостаточности в покое
Принципы медикаментозного лечения сердечной недостаточности
Лечение сердечной недостаточности должно быть направлено на достижение следующих целей:
- Выявление и лечение основного заболевания, приведшего к развитию сердечной недостаточности. Например, в ряде случаев может потребоваться интенсивная антигипертензивная терапия, протезирование клапанов или полный отказ от употребления алкоголя и т.д.
- Устранение факторов, провоцирующих развитие декомпенсации у больных с компенсированной сердечной недостаточностью (например, адекватное лечение аритмий, ограничение выпитой жидкости или потребления поваренной соли).
- Лечение декомпенсации сердечной недостаточности:
- Уменьшение застоя крови: (ограничение потребления поваренной соли, ограничение выпитой жидкости, медикаментозная терапия (мочегонные средства), направленная на выведение из организма избытка воды и натрия.
- Увеличение сердечного выброса и улучшение кровоснабжения жизненно важных органов. С этой целью применяют инотропные препараты, которые усиливают сократимость сердечной мышцы, а также различные сосудорасширяющие средства.
Хирургическое лечение сердечной недостаточности
Сердечная недостаточность у больных кардиохирургического профиля встречается в самых различных возрастных группах и при самых разнообразных заболеваниях сердца. Интенсивному лечению, в том числе и хирургическому, подлежат пациенты с высокой угрозой для жизни и резистентные к медикаментозной терапии. К этой категории относятся больные с дилатационной кардиомиопатией, ишемической кардиомиопатией, гипертрофической обструктивной кардиомиопатией (ГОКМП) и посткардиотомной (послеоперационной) сердечной недостаточностью.
Фармакологические методы лечения сердечной недостаточности, бесспорно, играют важнейшую роль, однако имеющиеся в настоящее время препараты оказывают весьма опосредованный и нестойкий эффект у пациентов в терминальной стадии заболевания. Однолетняя выживаемость таких больных составляет не более 50%. И это притом, что ежегодно синтезируется более 30 новых препаратов, направленных на лечение сердечной недостаточности. Единственным признанным эффективным вариантом лечения критической сердечной недостаточности остается трансплантация сердца. На сегодняшний день в мире выполнено более 70 000 операций по трансплантации сердца. При этом ежегодно выполняется более 3 000 операций, из них около 2 000 в США. Однако количество больных, нуждающихся в пересадке сердца, значительно превышает количество доноров. Как результат этого – высокая, увеличивающаяся с каждым годом смертность пациентов, находящихся в «листе ожидания». Такая неутешительная динамика требует развития новых способов лечения критической сердечной недостаточности, и интерес к данной проблеме за последнее время значительно возрос среди ученых всего мира. Подтверждением этому является успешная разработка систем вспомогательного кровообращения, полностью или частично облегчающих работу патологически измененного сердца.
Под понятием «система вспомогательного кровообращения» следует понимать механические системы, производящие перемещение крови с целью снижения работы миокарда и/или увеличения его энергоснабжения.
ОСТРОЕ ЛЕГОЧНОЕ СЕРДЦЕ У ДЕТЕЙ


ВА-N18 от 01/06/2000, стр. 34-36 /.. Материалы конференций


Под понятием «легочное сердце» (син.: легочно-сердечная или кардио-пульмональная недостаточность) понимают состояние гипертрофии правых отделов сердца, развивающейся в результате повышения давления в малом круге кровообращения. Однако такое определение применимо лишь для характеристики хронического легочного сердца. Между тем хорошо известно, что при многих острых заболеваниях бронхолегочной системы, сопровождающихся легочной гипертензией, возникает перегрузка правых отделов сердца с последующим развитием их недостаточности. По мнению Ю.Ф.Домбровской (1957), подобное состояние следует расценивать как острое легочное сердце.
На Всесоюзном симпозиуме в Минске (1964) было предложено различать легочное сердце по характеру течения — острое, подострое, хроническое; по степени компенсации — компенсированное и декомпенсированное; по основным патогенетическим механизмам — легочное сердце васкулярного, бронхолегочного или торакодиафрагмального генеза. Однако при любой из указанных патогенетических форм в основе развития легочной гипертензии лежат васкулярные изменения, обусловленные либо анатомическим уменьшением сосудистого русла малого круга кровообращения, либо вазоконстрикцией. Поэтому вряд ли целесообразно выделять эти формы.
Этиология и патогенез. Наиболее часто острое легочное сердце (ОЛС) у детей является следствием токсических или деструктивных пневмоний, бронхиолитов, тяжелых приступов бронхиальной астмы, «шокового» легкого III — IV стадий.
В основе патогенеза ОЛС лежит повышение давления в малом круге кровообращения. Спазм легочных сосудов наступает под влиянием снижения парциального давления кислорода в альвеолах, повышения аэродинамического сопротивления в бронхах, возбуждения симпатоадреналовой системы, развития артериальной гипоксемии и гиперкапнии, тканевой гипоксии с накоплением биологически активных веществ типа серотонина и гистамина, повышения внутричерепного давления, увеличения вязкости крови.
При действии указанных механизмов формируется прекапиллярная форма гипертеизии малого круга кровообращения (Halmagyi, 1967). Повышение давления в легочной артерии может быть связано и с посткапиллярной формой гипертонии, возникающей в результате несостоятельности левых отделов сердца и застоя крови в легочных венах.
Исследование функционального состояния сердечно-сосудистой системы при острой дыхательной недостаточности с использованием ЭКГ, поликардиографии и реографии легочной артерии позволило нам (Е.В.Неудахин, 1975) выделить в развитии ОЛС фазы адаптации (гиперкомпенсации), относительной компенсации и декомпенсации, которые характеризуются определенными электрофизиологическими признаками.
Фаза адаптации: электрокардиографические и реографические проявления гипертензии в малом круге кровообращения на фоне симптомов дыхательной недостаточности, электрокардиографические признаки метаболических изменений в миокарде желудочков, фазовый синдром гипердинамии систолы правого желудочка сердца. Гипердинамическая реакция миокарда, указывающая на гиперфункцию последнего, расценивается нами как преднедостаточность сердца.
Фаза относительной компенсации (скрытая правожелудочковая недостаточность): гиподинамическая реакция миокарда правого желудочка сердца на фоне выраженной дыхательной недостаточности и нарастающих нарушений гемодинамики в малом круге кровообращения при отсутствии застоя крови в большом.
Фаза декомпенсации: выраженная гиподинамическая реакция миокарда правого желудочка сердца с нарушением кровообращения в большом круге. Эта фаза является клиническим проявлением легочно-сердечной недостаточности, оценку которой по степеням можно проводить по общепринятой классификации Н.Д.Стражеско и В.Х.Василенко. При ОЛС смена указанных фаз происходит достаточно быстро.
Однако для обоснования понятия «острое легочное сердце» необходимо патоморфологическое подтверждение наличия изменений в кардиопульмональной системе, особенно в правых отделах сердца.
При патоморфологическом и гистохимическом методах исследования кардиопульмональной системы у детей, умерших от острой пневмонии нами (Н.Н.Пеший, 1984) установлены три варианта изменений. Для первого варианта характерны нормальная масса сердца, дилатация правого предсердия, повышение активности сукцинатдегидргеназы (СДГ) в миокарде правого желудочка сердца, нормальная активность лизосомального фермента -кислой фосфатазы (КФ). При гистологическом исследовании легочных сосудов определялось утолщение среднего слоя легочных артериол за счет отека и гиперплазии мышечных волокон, увеличение количества артериовенозных анастомозов.
При втором варианте отмечалось уменьшение массы сердца, тоногенная дилатация правого желудочка. В его миокарде обнаружены участки повреждения в виде лизиса отдельных миоцитов, в которых активность СДГ была снижена, а КФ — повышена. Последнее указывает на угнетение окислительно-восстановительных процессов и усиление протеолитических.
Третий вариант характеризовался увеличением массы сердца, миогенной дилатацией правого желудочка сердца, наличием в его миокарде контрактурных повреждений, сопровождающихся зернисто-глыбчатым распадом, значительным снижением активности СДГ и повышением КФ.
Таким образом, результаты патоморфологических и гистохимических исследований свидетельствуют о стадийности развития ОЛС, что подтверждает данные электрофизиологических исследований. На основании сопоставления полученных результатов мы (Е.В.Неудахин и соавт., 1993) установили характер внутрисердечных адаптационно-компенсаторных механизмов и последовательность их включения при развитии ОЛС.
По нашему мнению, сначала включаются «биохимические» механизмы адаптации, что подтверждает ся повышением активности СДГ в миокарде правого желудочка при первом варианте ОЛС. При нарастании легочной гипертензии, гипоксии, метаболических нарушений биохимические механизмы истощаются и происходит включение следующего «физиологического» уровня компенсаторных механизмов, о чем свидетельствует развитие тоногенной дилатации правого желудочка сердца, снижение активности СДГ и повышение активности КФ. На этом этапе компенсаторной реакцией является «физиологический» механизм Франка-Старлинга. Для переключения с «биохимического» уровня адаптации на «физиологический» уровень, по нашим данным, необходима активация лизосомальных ферментов (в т.ч. — КФ), которые как раз и обеспечивают запуск названного механизма. Дальнейшее нарастание активности лизосомальных ферментов ведет к развитию миогенной дилатации правого желудочка сердца, к срыву (истощению) «физиологического» уровня адаптации и в итоге — к декомпенсации сердечной деятельности.
На основании патоморфологических исследований можно выделить три варианта ОЛС: 1) ОЛС с дилатацией правого предсердия; 2) ОЛС с тоногенной дилатацией правого желудочка; 3) ОЛС с миогенной дилатацией правого желудочка.
Классификация. С учетом вышесказанного классификация ОЛС, по нашему мнению (В.А.Таболин, Н.Н.Пеший, Е.В.Пеудахин, А.П.Гасюк, 1990), может быть представлена следующим образом (табл. 1).
Классификация острого легочного сердца (ОЛС)
Стеноз митрального клапана
Митральный стеноз — сужение левого атриовентрикулярного отверстия вследствие срастания между собой створок двустворчатого клапана, изменения подклапанных структур и фиброзной дегенерации клапанного кольца. Это создает препятствия току крови из левого предсердия и сопровождается уменьшением ударного объема и минутного объема кровообращения. Митральный стеноз ведет к возникновению синдрома легочной гипертензии.
Наиболее часто причиной возникновения митрального стеноза является ревматизм. Стенозирование левого атриовентрикулярного отверстия отмечается у 25% больных с заболеваниями сердца ревматического генеза. Приблизительно у 40% пациентов формируется комбинированный митральный порок (стеноз и недостаточность) (рис. 1).
Вторым о частоте является митральный стеноз врожденной этиологии (врожденный митральный стеноз, синдром Лютембаше, трехпредсердное сердце, врожденная мембрана в полости левого предсердия).
К стенозированию левого атриовентрикулярного отверстия могут также приводить опухоли (миксома), наличие шаровидного тромба в полости левого предсердия, крупные вегетации при инфекционном эндокардите митрального клапана.
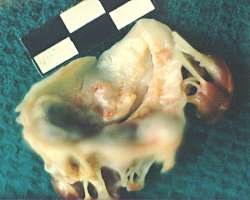 | Рис. 1 Иссеченный митральный клапан. Створки резко фиброзно изменены. Отверстие митрального клапана щелевидное. В толще створок — отложения солей кальция. |
Очень редко митральный стеноз может быть осложнением системной красной волчанки, ревматоидного артрита, злокачественного карциноида, мукополисахаридоза Гунтера-Харлей.
Классификация. Наиболее широкое распространение в России получила классификация митрального стеноза, предложенная А.Н. Бакулевым и Е.А. Дамир. Она включает 5 стадий развития порока:
- I – стадия полной компенсации кровообращения. Больной не предъявляет никаких жалоб, однако при объективном обследовании обнаруживаются признаки, характерные для митрального стеноза. Площадь митрального отверстия составляет 3-4 см 2 , размер левого предсердия — не более 4 см.
- II – стадия относительной недостаточности кровообращения. Больной жалуется на одышку, возникающую при физической нагрузке, выявляются признаки гипертензии в малом круге кровообращения, несколько повышено венозное давление, однако выраженных признаков недостаточности кровообращения не выявляется. Площадь митрального отверстия около 2 см 2 . Размер левого предсердия от 4 до 5 см.
- III – начальная стадия выраженной недостаточности кровообращения. В этой стадии имеются явления застоя в малом и большом кругах кровообращения. Сердце увеличено в размерах. Венозное давление значительно повышено. Отмечается увеличение печени. Площадь митрального отверстия составляет 1-1,5 см 2 . Размер левого предсердия — 5 см и более.
- IV – стадия резко выраженной недостаточности кровообращения со значительным застоем в большом круге. Сердце значительно увеличено в размерах, печень больших размеров, плотна. Высокое венозное давление. Иногда небольшой асцит и периферические отеки. К этой стадии также относятся и больные с мерцательной аритмией. Терапевтическое лечение дает улучшение. Митральное отверстие менее 1 см 2 , размер левого предсердия превышает 5 см.
- V – соответствует терминальной дистрофической стадии недостаточности кровообращения по В.Х. Василенко и Н.Д. Стражеско. Отмечаются значительное увеличение размеров сердца, большая печень, резко повышенное венозное давление, асцит, значительные периферические отеки, постоянная одышка, даже в покое. Терапевтическое лечение не дает эффекта. Площадь митрального отверстия менее 1 см 2 , размер левого предсердия более 5 см.
Клиническая картина. Основной жалобой больных митральным стенозом является одышка как следствие уменьшения минутного объема кровообращения и нарушения механизма внешнего дыхания. Интенсивность ее находится в прямой зависимости от степени сужения митрального отверстия. Сердцебиение — второй после одышки признак митрального стеноза и представляет собой проявление компенсаторного механизма в условиях недостаточного минутного объема кровообращения. Кровохарканье и отек легких встречаются реже и возникают главным образом при сочетании ревматического васкулита с выраженным застоем в легочных венах и бронхиальных сосудах. Реже кровохарканье связано с инфарктом легкого. Отек легких обусловлен выраженной гипертензией малого круга в сочетании с левожелудочковой недостаточностью. Возникающая при этом гипоксия приводит к повышению проницаемости сосудистой стенки и проникновению жидкой фракции крови в альвеолы. Кашель — частый признак митрального стеноза и, как правило, связан с застойным бронхитом. Боли в области сердца — менее постоянный признак этого порока, они появляются лишь при значительном увеличении левого предсердия, сопровождающегося сдавлением левой венечной артерии. Общая физическая слабость весьма характерна для митрального стеноза и является следствием хронической гипоксии организма, в частности скелетной мускулатуры.
Клинические проявления митрального стеноза весьма разнообразны. Он может маскироваться нарушениями внутрисердечной гемодинамики от других причин, может вообще не вызывать субъективных ощущений и в то же время обусловить внезапный приступ острой сердечной недостаточности со смертельным исходом.
Диагностика. В типичных случаях отмечается бледность кожных покровов с цианозом губ, щек, кончика носа. Аускультативные данные весьма характерны: «хлопающий», «пушечный» первый тон, акцент и раздвоение второго тона над легочной артерией. Второй компонент этого тона регистрируется в виде «щелчка». Диастолический шум с пресистолическим усилением над верхушкой сердца — характерный аускультативный признак митрального стеноза, если сохраняется синусовый ритм. При тахикардии перечисленные аускультативные признаки могут отсутствовать. Поэтому при обследовании больного необходимо добиться уменьшения частоты сердечных сокращений (успокоить, придать больному горизонтальное положение, возможно, прибегнуть к медикаментозным средствам), после чего повторить аускультацию и фонокардиографию.
Рентгенологические признаки достаточно характерны: сердце митральной конфигурации с резким расширением легочной артерии и ушка левого предсердия, выраженный застой в сосудах легких смешанного характера, в тяжелых случаях — признаки гемосидероза. На рентгенограмме в правой боковой проекции видно увеличение правого желудочка с заполнением ретростернального пространства. Контрастированный пищевод в этой проекции отклоняется по дуге малого радиуса (до 6 см), что свидетельствует об увеличении левого предсердия.
Характерным электрокардиографическим признаком являются отклонение электрической оси сердца вправо, признаки гипертрофии правого желудочка и левого предсердия, а также мерцательной аритмии в более поздние стадии заболевания. Фонокардиографические признаки, как правило, соответствуют да иным аускультации. Весьма характерны эхокардиографические данные, позволяющие с большой точностью измерить митральное отверстие, составить представление о характере анатомических изменений клапана (рис. 2, а, б), распознать наличие тромбоза левого предсердия и оценить функцию сердца.
Лечение. Основным методом лечения больных с митральным стенозом является хирургический. Оперативное лечение показано пациентам с заболеванием II-IV стадий. Больные с I стадией в операции не нуждаются. Пациентам с V стадией митрального стеноза хирургическое лечение абсолютно противопоказано, так как оно сопряжено с очень высоким риском.
При митральном стенозе возможно выполнение как закрытых (т.е. без использования искусственного кровообращения), так и открытых (в условиях искусственного кровообращения) оперативных вмешательств. В последнюю группу входят клапансохряняющие вмешательства (открытая митральная комиссуротомия), а также протезирование клапана искусственным протезом.
При неосложненном митральном стенозе возможно выполнение закрытой митральной комиссуротомии. Операция заключается в пальцевом или инструментальном расширении митрального отверстия путем разделения сращений митрального клапана в области комиссур с подклапанными структурами. Закрытая митральная комиссуротомия может быть выполнена из лево- или правостороннего доступа к сердцу, однако, в настоящее время она, в основном, выполняется из правосторонней переднебоковой торакотомии. Этот доступ обеспечивает, при необходимости, возможность перехода к коррекции порока в условиях искусственного кровообращения. При выполнении вмешательства из правостороннего доступа к сердцу палец и инструмент вводят к митральному клапану через межпредсердную борозду (рис. 3, а, б). В случаях наличия в левом предсердии тромба, обширного кальциноза митрального клапана, неэффективности попыток закрытой комиссуротомии, а также при возникновении выраженной недостаточности клапана (II и более степени) после разделения комиссур или повреждения клапанных структур переходят к открытой коррекции порока в условиях искусственного кровообращения.
Выполнение открытой митральной комиссуротомии заключается в рассечении комиссур и подклапанных сращений стенозированного митрального клапана под контролем зрения в условиях искусственного кровообращения (Рис. 4). При невозможности сохранения клапана (при тяжелых подклапанных сращениях, массивном кальцинозе, наличии признаков активного инфекционного эндокардита), а также в случае возникновения недостаточности митрального клапана после предшествующих комиссуротомий выполняют его протезирование (рис. 5) с использованием искусственных или биологических протезов (рис. 6).
Одним из возможных методов коррекции митрального стеноза при его неосложненном течении является чрескожная баллонная дилатация. Суть метода заключается в проведении под рентгеновским и ультразвуковым контролем специального баллона в отверстие митрального клапана и его расширении посредством резкого раздувания баллона, вследствие чего обеспечивается разделение створок клапана и ликвидация стеноза. Инструментарий к митральному клапану может быть доставлен при помощи двух доступов: антеградного (из бедренной вены через межпредсердную перегородку в левое предсердие) или ретроградного (из бедренной артерии в левый желудочек).
В целом результаты оперативного лечения неосложненного митрального стеноза хорошие. Сразу же после операции больные отмечают уменьшение одышки, постепенно исчезают явления недостаточности кровообращения. Отдаленные результаты зависят от исходного состояния больных и стадии порока, в которой предпринято оперативное вмешательство. Наилучшие они, если операция выполнена во II-III стадии, когда вторичные изменения во внутренних органах, обусловленные недостаточностью кровообращения, носят обратимый характер. Подавляющее число таких больных через 4-12 мес. возвращаются к своей прежней работе. Оперативное лечение в стадии тяжелых расстройств общего кровообращения с необратимыми морфологическими изменениями во внутренних органах (склеротическая фаза легочной гипертензии, сердечный цирроз печени, тяжелые дистрофические изменения миокарда и пр.) не позволяет получить достаточно полной реабилитации пациентов и стабильности достигнутых результатов в отдаленные сроки. Все больные, перенесшие оперативное лечение, должны находиться под наблюдением ревматолога и получать сезонное противоревматическое лечение, так как сохраняется опасность развития рестеноза или формирования недостаточности клапана, по поводу которых часто необходимо повторное оперативное вмешательство.
Диагностика и лечение инфаркта миокарда (Александров)
Инфаркт миокарда – симптомы, причины, профилактика, диагностика и лечение в клинике «Парацельс», Александров
ВНИМАНИЕ: Доступны онлайн-консультации врачей (более 18 специальностей).
Инфаркт миокарда является неотложным угрожающим жизни состоянием. Клинически проявляется жгучими, давящими или сжимающими болями за грудиной, отдающими в левую руку, ключицу, лопатку, челюсть, одышкой, чувством страха, холодным потом. Человек с сердечным приступом должен быть госпитализирован в отделение реанимации как можно скорее. Успех лечения и жизнь пациента напрямую зависят от того, как быстро будет распознан инфаркт и вызвана скорая помощь. Важно, чтобы каждый знал первые признаки инфаркта и мог своевременно помочь своим близким.

Общие сведения об инфаркте миокарда
Инфаркт миокарда ー это отмирание участка сердечной мышцы, которое происходит вследствие дефицита кровенаполнения. Как правило, сердечный приступ не развивается внезапно, ему предшествует ишемическая болезнь сердца или другая патология того органа, которая ведет к нарушению притока крови к миокарду. В условиях кислородного и энергетического голодания клетки гибнут. На начальном этапе этот процесс обратим, если восстановить приток крови, область отмирания можно ограничить и предотвратить тяжелую сердечную недостаточность.
Классификация инфарктов миокарда
В зависимости от того, какая часть сердечной стенки повреждена, выделяют такие виды инфарктов:
- интрамуральный ー зона отмирания расположена в глубине миокарда;
- трансмуральный ー затрагивает всю толщину стенки;
- субэндокардиальный ー очаг поражения располагается близ внутренней выстилки сердца;
- субэпикардиальный ー возле внешней сумки сердца.
По характеру течения выделяют:
- острый инфаркт (первичный);
- рецидивирующий, развивается в период 2-х месяцев после острого;
- повторный, развивается позже 2-х месяцев после первого инфаркта.
По характеру симптомов:
- типичная форма, характеризуется болью в груди с иррадиацией в левую руку и левую половину тела;
- атипичные формы (абдоминальная ー боль в животе, астматическая ー сопровождается выраженной одышкой, церебральная ー с головокружением, спутанностью сознания, отечная, периферическая ー боль в руке, лице, шее, безболевая, комбинированная).
Механизм развития и причины инфаркта миокарда
Львиная доля сердечных приступов развивается на фоне атеросклеротического поражения коронарных сосудов и аорты (образования холестериновых бляшек в стенке сосудов). Другие возможные причины нарушения кровообращения в сердечной мышце ー спазм сосудов и тромбоз. Все это приводит к тому, что клетки не получают нужного количества кислорода и умирают.
Основные причины инфаркта миокарда:
- ишемическая болезнь сердца, атеросклероз;
- резкие физические нагрузки или стрессы при ИБС;
- тромбоз коронарных артерий.
Инфаркт миокарда у детей
Считается, что данная патология грозит только пожилым людям, но это не так. Сердечный приступ может случиться и у ребенка в таких случаях:
- воспаление коронарных артерий при инфекционных заболеваниях, ревматоидном артрите, волчанке и других аутоиммунных патологиях;
- инфекционный и ревматический эндокардит (после перенесенной ангины например);
- аномалии строения сосудов сердца;
- травмы сердца;
- феохромоцитома ー опухоль, постоянно продуцирующая адреналин;
- врожденные пороки сердца;
- опухоли сердца.
Факторы риска развития инфаркта миокарда
К развитию атеросклероза, ИБС и как следствие, инфаркта ведут такие факторы:
- повышенный холестерин крови (вследствие неправильного питания или болезней обмена веществ);
- ожирение;
- гипертоническая болезнь;
- курение;
- малоподвижный образ жизни;
- сахарный диабет.
Симптомы инфаркта миокарда
Клетки миокарда умирают не сразу, так как гипоксия развивается постепенно, они “страдают” 1-2 часа до окончательной смерти. В это время их еще можно спасти, поэтому своевременное обращение за помощью определяет дальнейший исход.
Предынфарктное состояние
Предвестники инфаркта могут появиться за несколько часов и даже дней до приступа. Обратившись в этот период за медицинской помощью можно предотвратить катастрофу.
Возможные признаки надвигающегося сердечного приступа:
- появление болей за грудиной во время физических нагрузок, эмоционального напряжения;
- ощущения перебоев в работе сердца, головокружение, учащение пульса;
- учащение приступов стенокардии;
- боль в груди не устраняется таблетками нитроглицерина.
Важно! Среди всех зарегистрированных инфарктов миокарда, около 20% имеют смертельный исход уже в первый час приступа. В этом виноваты не врачи и не “запущенная медицина”, смерть наступает еще до обращения за помощью из-за того, что сам больной и его окружающие не могут распознать приступ и медлят с вызовом скорой помощи. Поэтому, если у ваших близких имеется повышенный риск развития инфаркта, изучите симптоматику и алгоритм действий в случае сердечного приступа.
Симптомы острого инфаркта миокарда
Инфаркт миокарда проявляется болевым синдромом. Боль локализуется в груди, отдает в левую руку, плечо, половину лица, бок. Характер боли ー давящий, жгучий. Во время приступа человек ощущает нехватку воздуха, страх смерти, выступает холодный липкий пот, кожные покровы бледнеют.
Отличительная черта инфаркта от стенокардии: при первом боль не утихает в покое или после приема нитроглицерина, длится более 20 минут.
Диагностика инфаркта миокарда
После госпитализации пациенту проводят такие диагностические мероприятия:
- ЭКГ;
- клинический и биохимический анализ крови;
- анализ крови на креатинфосфокиназу (КФК), лактатдегидрогеназу (ЛДГ), тропонин;
- ЭхоКГ (УЗИ сердца);
- коронарография.
Эти методы помогают подтвердить диагноз инфаркта, уточнить локализацию очага некроза, определиться с тактикой лечения.
Прогноз и профилактика инфаркта
Наибольшая летальность от инфаркта миокарда отслеживается в первые сутки поэтому, если медицинская помощь была оказана своевременно, то шансы на выздоровление значительно возрастают. Общий прогноз зависит от площади поражения сердечной мышцы.
Для профилактики необходимо следовать таким принципам:
- отказ от курения и алкоголя;
- правильное, сбалансированное питание;
- регулярная физическая активность (согласовать с врачом);
- регулярные профилактические посещения кардиолога при наличии заболеваний сердечно-сосудистой системы.
Осложнения инфаркта миокарда
Возможные последствия заболевания:
- аритмии;
- кардиогенный шок;
- разрыв сердца;
- тромбоэмболия легочной артерии;
- эндокардит.
Диагностика и лечение инфаркта миокарда и предынфарктного состояния в Медицинском центре «Парацельс»
В медицинском центре “Парацельс” г. Сергиев Посад ведет консультативный прием кардиохирург с многолетним опытом работы, который поможет диагностировать заболевания сердечно-сосудистой системы и выявить предрасположенность к сердечному приступу.
В случае необходимости хирургического лечения, пациенты нашего медицинского центра будут направлены в Москву в ФГБУ НМИЦ ССХ им. А.Н.Бакулева Минздрава России в отделение Реконструктивной Хирургии Клапанов Сердца и Коронарных Артерий, где будет сделана операция на сердце по квоте ОМС.
Когда нужно обратиться к врачу?
Консультация кардиолога необходима человеку при появлении симптомов патологии сердечно-сосудистой системы (боли в груди, головокружение, кашель, одышка, синюшность кожных покровов и др.). Не стоит заниматься самолечением. Многочисленные методы народной медицины допустимы к применению только после разрешения доктора и после лечения острого периода заболевания.
Медикаментозное лечение инфаркта миокарда и предынфарктного состояния
Пациентам в предынфарктном состоянии назначают препараты, улучшающие кровоснабжение сердечной мышцы, антиатеросклеротические средства, витаминно-минеральные комплексы.
В остром периоде инфаркта показаны анальгетики, антикоагулянты (предотвращают свертывание крови) и тромболитики (растворяют уже образовавшийся тромб).
Хирургическое лечение
Более эффективно восстановить кровоснабжение миокарда можно путем оперативного вмешательства, которое необходимо провести в первые часы сердечного приступа, тогда шансы на успешное исцеление наиболее велики.
Аортокоронарное шунтирование
Метод операции заключается в создании обходного пути кровоснабжения пораженного участка миокарда. Аорту и коронарный сосуд дальше закупорки соединяют при помощи участка вены, взятой с голени пациента.
Ангиопластика коронарной артерии
Сужение артерии можно устранить, путем введения инструмента, который расширяет артерию, через бедренную вену. Далее, устанавливают стент, который фиксирует форму сосуда, предотвращая его сужение и восстанавливает кровоток.
Реабилитация после лечения инфаркта миокарда Медицинском центре «Парацельс»
После завершения острого периода важно продолжать лечение, потому что улучшение может быть мнимым. Пациенты, перенесшие сердечный приступ, нуждаются в долгосрочной реабилитации, в которую входят:
- массажи;
- физиопроцедуры;
- лечебная физкультура;
- психологическая помощь.
Посещения кардиолога должны быть регулярными: в реабилитационном периоде по назначению врача, далее один раз в полгода необходимо делать ЭКГ и ЭхоКГ.
В медицинском центре «Парацельс» работают терапевты, кардиологи, неврологи и другие специалисты с большим опытом работы. Команда наших врачей обеспечивает комплексный подход к лечению осложнений инфаркта и реабилитации после основного лечения.
Записаться на приём к врачу можно каждый день, без выходных, выбрав удобный для Вас способ:
Записаться к врачу по телефону:
Оставить заявку (мы перезвоним в ближайшее время)
С заботой о Вашем здоровье, Медицинский центр “Парацельс”



